インフルエンザウイルスのノイラミニダーゼ
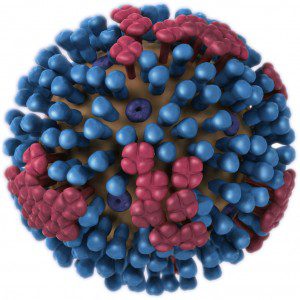 インフルエンザウイルス粒子は、脂質膜に包まれたウイルスRNAゲノムで構成されています(図示)。 膜、またはエンベロープは、ウイルスタンパク質の3つの異なる種類が含まれています。 ヘマグルチニン分子(HA、青)は、細胞受容体に付着し、細胞へのウイルス侵入のプロセスを開始する。 私は感染時のHAとその機能について書いていますが(第1条と第2条)、ノイラミニダーゼ(NA、赤)やM2(紫)タンパク質については書いていません。 まずはNAに取り組みましょう。
インフルエンザウイルス粒子は、脂質膜に包まれたウイルスRNAゲノムで構成されています(図示)。 膜、またはエンベロープは、ウイルスタンパク質の3つの異なる種類が含まれています。 ヘマグルチニン分子(HA、青)は、細胞受容体に付着し、細胞へのウイルス侵入のプロセスを開始する。 私は感染時のHAとその機能について書いていますが(第1条と第2条)、ノイラミニダーゼ(NA、赤)やM2(紫)タンパク質については書いていません。 まずはNAに取り組みましょう。
NAタンパク質の重要な機能は、糖タンパク質からシアル酸を除去することである。 シアル酸はウイルスの糖蛋白質と同様、多くの細胞の表面蛋白質にあります;インフルエンザウイルスがHA蛋白質によって付けるのは細胞の受容器 HAおよびNA上のシアル酸は、タンパク質が分泌経路を介して細胞表面に移動するにつれて除去される。 新たに放出されたウイルス粒子は、細胞表面上に存在するシアル酸へのHAの結合によって潜在的に凝集する可能性がある。 年前にピーター Paleseはウイルスのノイラミニダーゼが不活性化されるときインフルエンザウイルスが細胞の表面で総計を形作ることを示した。 したがって、NAは、感染細胞の表面からの子孫ウイルス粒子の放出に必須である酵素である。
NAタンパク質は、ウイルスが気道に侵入する際にも機能します。 気道の上皮細胞は、多くのシアル酸含有糖タンパク質を含む複雑な保護コーティングである粘液を浴びている。 インフルエンザのビリオンが呼吸器管に入るとき、シアル酸を結合する粘液で引っ掛かる。 この相互作用はウイルスが敏感な細胞に結合することを防ぐ糖蛋白質からのシアル酸を裂くNA蛋白質の行為のためではなかった。 ウイルス粒子は細胞に遭遇すると、シアル酸含有受容体に結合し、NAタンパク質が細胞表面から炭水化物を切断する前に細胞に急速に取り込まれる。
ウイルス産生のためのNAの本質的な性質は、ウイルス放出を阻害するように設計された新しい薬を開発するために利用されています。 タミフル(Oseltamivir)およびRelenza(Zanamivir)は両方NAの酵素の活動的な場所で堅く結合するシアル酸の構造模倣物です。 薬物に結合すると、NAは細胞表面からシアル酸を除去することができず、その結果、新たに合成されたウイルスは固定化されたままである。 結果はvirionsが1つの細胞から別のものに広がることができないのでウイルスの伝染の阻止です。
この記事は、インフルエンザウイルスの生物学と病因に関する一連の記事であるインフルエンザ101の一部です。