殻の中の電子
![]()
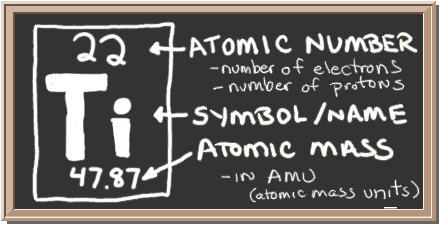
黒板をチェックしてください。 左側のボックスには、1つの要素について知る必要があるすべての情報があります。 それはあなたに1つの原子の質量、内部に何個あるのか、そして周期表のどこに置くべきかを示します。
今、私たちは、要素のテーブル内の第四の期間/行で作業しています。 中性原子内の電子の数を知る簡単な方法があるかもしれませんが、それらの電子の配置はもう少し複雑になります。 周期4の基本的な要素(表の左右)の電子の配置と、遷移要素のより複雑な配置(行の中央)を見てみましょう。 これはあなたの頭の上に少しだと思う場合は、戻って、もう少し単純な組織を持っている要素1-18を見てください。
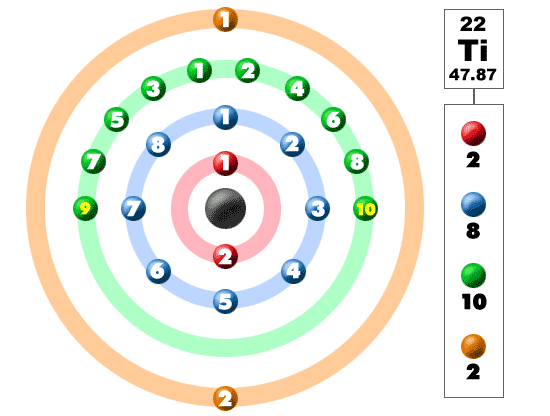
下の写真を見てください。 これらの色のボールのそれぞれは電子です。 原子では、電子は中心の周りを回転し、核とも呼ばれます。 電子は別々の殻/軌道にあるのが好きです。 あなたは原子構造についての詳細を学ぶように、あなたは電子が核の周りの定義された領域に滞在していないことを学びます。 それらは球およびダンベルのような形を含んでいる異なった形を持つことができる雲にあります。 あなたが私たちの内訳を見るとき、ここに示されているように、電子は常にきれいな順序ではないことを覚えておいてください。
この元素は遷移元素の一つであり、外殻に追加の電子を配置するのではなく、その下の電子に配置する。 第四の周期/行のために、これらの電子のすべてが18電子の最大に第三の殻を構築します。 最初の八は、第三の期間/行を介して私たちの旅行中に配置されたことを覚えておいてください。 周期表の第四の行は、スカンジウム(21)から亜鉛(30)の範囲の遷移金属を持っています。
チタンは金属です。 それは単なる金属ではなく、遷移金属です。 遷移金属であるため、特別な電子配置があります。 それは第三の殻ではなく、最も外側の第四の殻にその次の電子を追加します。 2-8-10-2の構成によって、チタニウムは世界にあり、他の要素によって結ばれて準備ができています。 それはハロゲンと酸素を含む多くの天然化合物を作る。 チタンは四つの余分な電子でそこにあるので、それは非常に柔軟であり、多くの化合物を形成します。