18.6:エポキシドの反応:開環
エポキシド開環反応-SN1対SN2、位置選択性、および立体選択性
エポキシドの非酵素的開環反応は、この章ですでに見てきた概念の多くの素晴らしい概要を提供する。 開環反応は、エポキシドの性質および反応条件に応じて、SN2またはSN1メカニズムのいずれかによって進行することができる。 エポキシドが非対称である場合、生成物の構造は、どの機構が支配的であるかによって変化する。 不斉エポキシドが塩基性メタノール中で加溶媒分解を受けると、SN2機構によって開環が起こり、置換されていない炭素が求核攻撃の部位であり、製品Bと:

逆に、酸性メタノール中で加溶媒分解が起こると、実質的なSN1特性を有する機構によって反応が起こり、より置換された炭素が攻撃部位である。 その結果、製品Aが優勢である。

これらはどちらも位置選択的反応の良い例です。 位置選択的反応では、2つの(またはそれ以上の)異なる構成異性体が生成物として可能であるが、1つは優先的に(または時には排他的に)形成される。
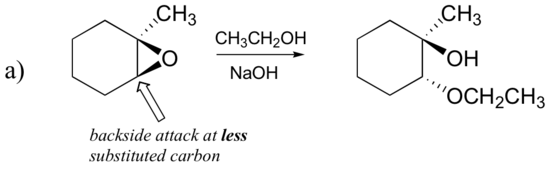
まず、基本的なSN2の場合を調べてみましょう。 脱離基は、開環前に酸素をプロトン化するために利用可能な酸がないため、アルコキシドアニオンである。 アルコキシドは貧弱な脱離基であり、したがって、求核剤からの”プッシュ”なしで環が開くことはまずない。
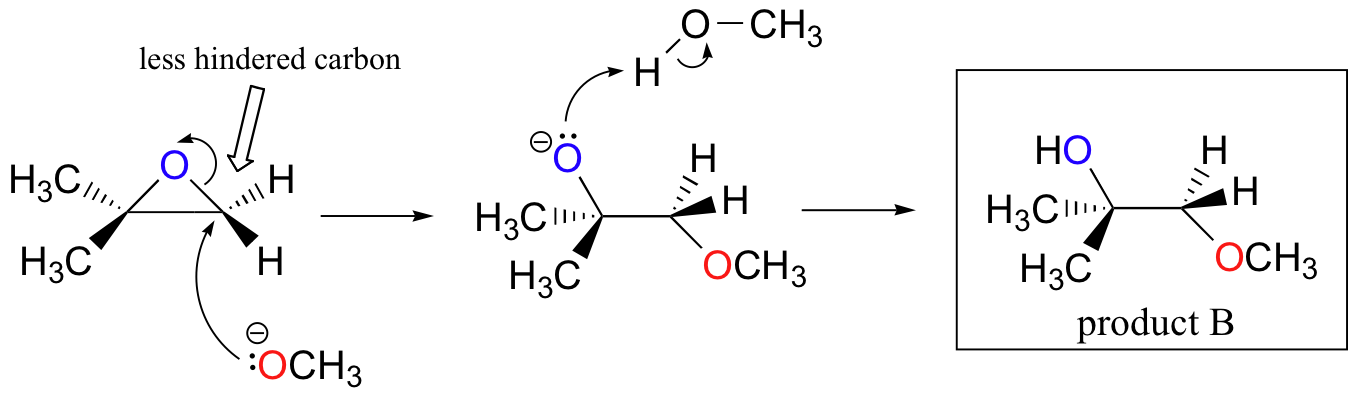
求核剤自体は強力である:脱プロトン化された負に帯電したメトキシドイオン。 求核置換反応が貧弱な脱離基と強力な求核剤を含む場合、SN2機構によって進行する可能性が非常に高い。
求電子剤はどうですか? エポキシドには2つの求電子性炭素があるが、SN2反応における求核剤の最良の標的は、最も妨げられていない炭素である。 これは観察された位置化学的結果を説明する。 他のSN2反応と同様に、裏面から求核攻撃が起こり、その結果求電子性炭素が反転する。
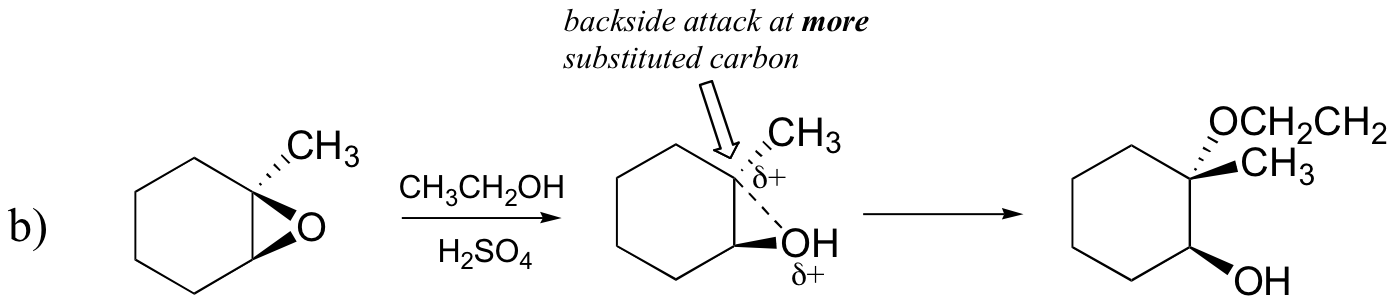
おそらく、酸触媒エポキシド開環反応を描写する最良の方法は、SN2とSN1機構の間のハイブリッド、または交差としてである。 まず、酸素がプロトン化され、良好な脱離基が形成される(以下のステップ1)。 その後、炭素-酸素結合が壊れ始め(ステップ2)、より置換された炭素上に正の電荷が蓄積し始める(炭素位置安定性についてのセクション8.4Bからの説

SN1反応とは異なり、求核剤は完全なカルボカチオン中間体が形成される前に求電子性炭素を攻撃する(ステップ3)。
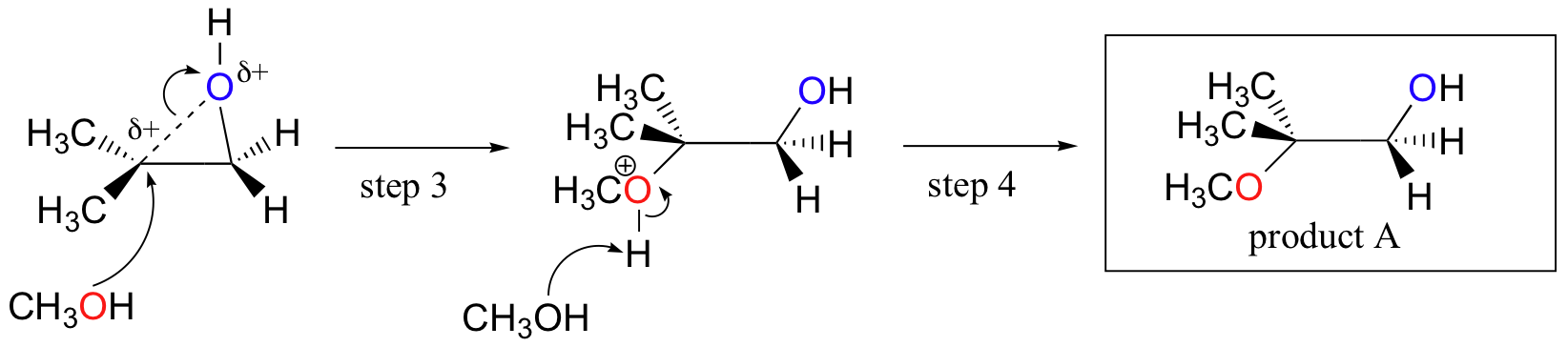
攻撃は、炭素-酸素結合がある程度の位置にあるため、(SN2反応のように)裏側から優先的に行われ、酸素は前面からの攻撃をブロックする。 しかし、位置化学的結果が塩基触媒反応とどのように異なるかに注意してください: 酸触媒プロセスでは、求核剤は、より高い程度の正電荷を保持するのはこの炭素であるため、より置換された炭素を攻撃する。
例18.6.1
以下に示すエポキシドを以下の方法で処理したときに起こる開環反応の主な生成物を予測する:
- エタノールおよび少量の水酸化ナトリウム
- エタノールおよび少量の硫酸
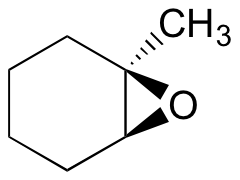
ヒント:位置化学と立体化学の両方を考慮してください!
回答