Bioorganic&Organic Chemistry
水素化–酸化反応
アルケン結合へのジボランのシス添加は、水和の非常に有用な方法を提供します。 ジボランは、0o-5ocでテトラヒドロフランまたはエーテル中の三フッ化ホウ素エーテルに水素化ホウ素ナトリウムを添加することによって生成することができる。 ジボランはボラン(BH3)の二量体であり、この試薬の安定な形態である(Scheme1)。
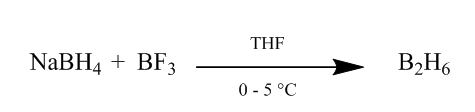
図1水素化ホウ素ナトリウムからのジボランの観察
アルケンへのジボランの添加は非常に迅速であり、一般に、試薬はγ系の二つの面の妨げの少ないものから添加する。 Cis添加は四つの中心遷移状態によって合理化された。 アルケンへのジボランの添加から生じるボラン錯体は、塩基性過酸化水素で処理することによって立体化学を保持してアルコールに変換される。 したがって、1-メチルシクロヘキセン1は水素化酸化によりtrans-2-methylcyclo-hexanol2が形成される。 機械論的な経路は(スキーム2)に描かれている。 水素化酸化によるアルケンのアルコールへの変換のための方法は、多くの天然物の合成に適用されている。 以下にいくつかの例を示します。

図2trans-2-methylcyclo-hexanolへの生成のための反応機構2
(±)ジュネノールと(±)アカロモンの合成
ユーデスモンセスキテルペン(±)ジュネノールと(±)アカロモンの合成中にbanerjeeと同僚によって水素化酸化反応の使用が観察された3。 これらのセスキテルペンの合成を達成するためにアルケン3を、出発物質として選択し、水素化-酸化を行い、アルコール4を得た(スキーム3)。 アルコールをJones reagent4で酸化して得られたケトン5を炭酸ジエチルと反応させた。 得られた生成物をメチルリチウムで処理してケトール6を得、イソプロピルケトン7への変換はそれぞれ脱水および水素化によって行われた。 ケトンの金属水素化物還元に続いてシクロヘキサン中の四酢酸鉛5で酸化すると、環状エーテル8が得られ、クロム酸と酢酸で酸化することによってケト酸9に変換された。 ベンゼンとピリジン中の四酢酸鉛による脱炭酸に続いて10%Agno3含浸シリカゲル以上の精製(±)アコラモン10を与えた。 メタノール中の水素化ホウ素ナトリウムによるアコラモン10の還元、得られた生成物の昇華に続いてジュネノール11が得られた。
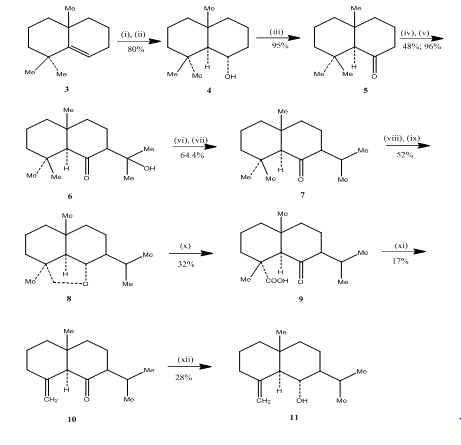
et2O、Nabh4、THF、0〜5℃;(i i)Naoh(1 0%)、H2O2(3 0%);(iii)Cro3/HMPT;(i v)Nah、CO(Oet)2、DME;(v)Meli、et2O、還流、2h;(v i)Hcl(1 0%)、H2O2(3 0%);(v i)Hcl(1 0%)、h2O2(3 0%);(v i)Hcl(1 0%)、h2O2(3 0%);(v i)Hcl(1 0%)、h2O2(3 0%);(v i)Hcl(1 0%)、h2O2(3 0%);(v i)Hcl(1 0%)、h2O2(3 0%);(v i)Hcl(1 0%)、h2O2(3 0%);(v i)Hcl((vii)h2、PTO2、meoh;(vii)h2、PTO2、meoh; (viii)Na、Etoh還流;(i x)Pb(Oac)4、C6H1 2;(x)Cro3、Acoh;(x i)Pb(Oac)4、C6H6、Py還流;(xii)Nabh4、Etoh。
ピシフェリン酸の合成
ピシフェリン酸の合成中に水素化酸化の使用が記録されており、6試験されたすべてのグラム陽性細菌に対して抗菌活性を示す三環式ジテルペンである。7合成経路はスキーム4に示されている。 アルケン13の水素化酸化は、既知の8ケトアルコール12から調製され、ジョーンズreagent4で酸化され、金属水素化物でそれぞれ還元され、アルコール14を得た。 250Wタングステンランプでベンゼン中の四酢酸鉛で酸化すると、環状エーテル15が得られた。 環状エーテルの亜鉛、ヨウ化亜鉛および酢酸8による開裂は、ピシフェロール16を提供した。 エステル17へのピシフェロールの変形は六つのステップで達成されました:
- 硫酸ジメチルによるメチル化
- ジョーンズ試薬による酸化
- ジアゾメタンによるエステル化
- 水素化ホウ素ナトリウムによる還元
- トシル化
- デトシル化
エステルl7は、臭化アルミニウムとエタンチオールで加熱することによってピシフェリン酸18に変換された。
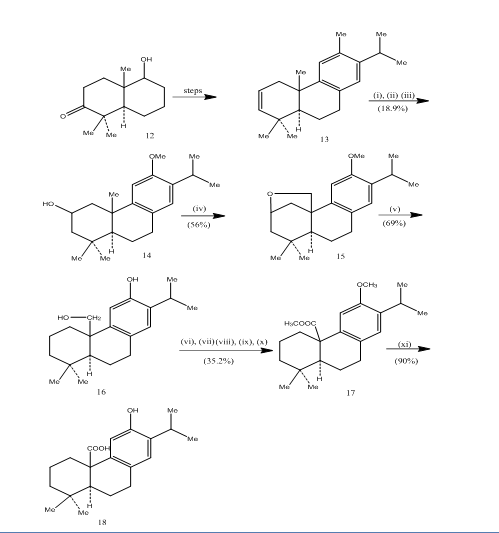
図4ピシフェリン酸1 8<1 3 8 7>試薬の合成:(i)BF3・Et2O、Nabh4;(i i)Naoh(1 0%)、H2O2(3 0%)、H2SO4−Hcro4;(iii)Lialh4、THF;(i v)Pb(Oac)4、Caco3、C6H6、2 5 0wタングステンランプ;(v)Zn、Zni、Mecooh(Mecooh)、Mecooh(Mecooh)、Mecooh(Mecooh)、Mecooh(Mecooh)、Mecooh(Mecooh)、Mecooh(Mecooh)、Mecooh(; (v i)Meso4、Me2Co;(vii)H2SO4−Hcro4;(viii)C H2N2、Et2O;(i x)Nabh4、Meoh;(x)Tscl、Py;(x i)Nai、Znダスト、DMF;(xii)Albr3、(C H2S H)2。
水素化-酸化反応は、(±)eudesの合成に適用されています-4(14),7(11)-ジエン-8-ワン、9タキソジオン、10ノルディテルペンアルコール、11その他多くのテルペン。12これらの例は、アルケンのアルコールへの変換およびその後のテルペノイド化合物への変換におけるチフルオロエーテル酸ホウ素の使用を明確に示している。
エポキシドの開裂
エポキシドはいくつかの試薬で開裂することができる。 ルイス酸ホウ素トリフルオライドエーテルもエポキシドの開裂に使用されており、多くの場合、得られた生成物はケトンに再配置される。 エポキシドの開裂には環化も伴う。 このレビューでは,三ふっ化エーテルほう素によるエポキシドの開裂と天然物の合成における得られた生成物の使用について議論した。
6-メトキシ-2-テトラローンの合成
三フッ化ホウ素エタレートによるエポキシドの開裂は、多くの有機化合物の合成のための重要な選択された出発物質である6-メトキシ-2-テトラローン20(スキーム5)の合成に利用されている13。 アルケン13 19のエポキシ化は、三フッ化ホウ素エタレートとジクロロメタン中の粗生成物の処理に続いてテトラロン20 36%の収率で与えられた。 開裂が硫酸と試みられたときにteralone20の収穫は他の二次生成物の形成と共に改善され(39%)、こうしてクロマトグラフの浄化は非常に面倒でした。
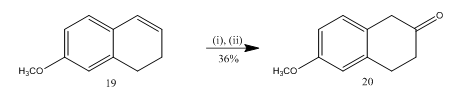
図5 6-メトキシ-2-テトラロン20
試薬の合成:(i)MCPBA、Ch2Cl2;(ii)Bf3Oet2
cupraneの合成
三フッ化ホウ素エタレートによるエポキシドの転位は、セスキテルペンcupraneの合成14中に非常に有用であることが証明された。 合成経路はスキーム6に記載されている。 6,6-ジメチル-1-p-トリルシクロヘキセン21は、エポキシド22を良好な収率で与え、ベンゼン中の三フッ化ホウ素エタレートで処理すると、アルデヒド23を低収率で得た。 アルデヒドのセミカルバゾンを水酸化カリウムで加熱し、セスキテルペンキュプレン24を許容可能な収率で供給した。 合成は、段階的にその簡潔さのために魅力的である。 エポキシド22の転位に使用される条件は、ケトン25へのさらなる転位を受ける傾向があるため、重要である。
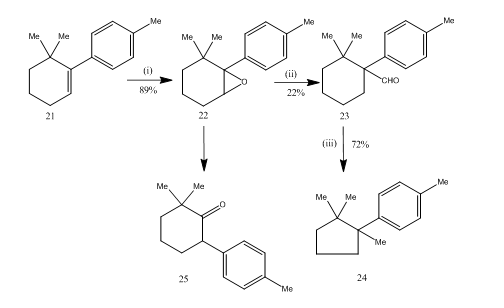
図6キュプレン
試薬の合成:(i)Phco3H、Chcl3;(ii)C6H6、Bf3Et2O;(iii)NH2NHCONH2、KOH
(±)カラハナエーテル
三フッ化エーテルホウ素の合成は、日本のホップから単離された揮発性モノテルペンであるカラハナエーテルの合成15中のエポキシドの開裂にも使用された16。 合成経路はスキーム7に記載されている。 ジエン26から得られたエポキシド27は、三フッ化ホウ素エタレートで処理されると環化を受け、生成物28が得られる。 環化は、おそらく中間体27(i)を介して発生しました。 金属水素化物還元は、tosylationにkarahanaether29をもたらしたジオールを与えた。 収率は不特定です。 エポキシドの切断はrosenolactone、17cyperolone、18maritimolのような多くのテルペンの統合のために利用されました。19
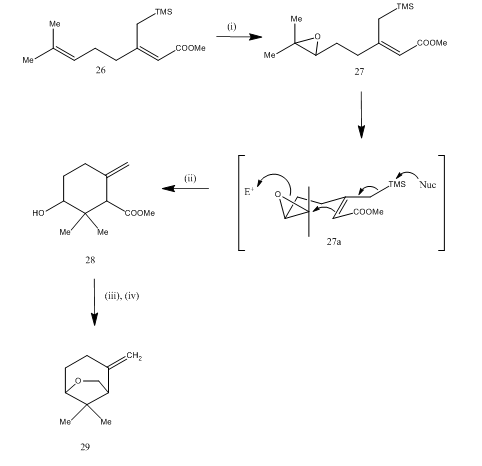
図7(±)カラハナエーテル<1 3 8 7>試薬の合成:(i)MCPBA;(i i)Bf3Et2O;(iii)Lialh4;(i v)Tscl,Py
エステル化
エステル化は、多くの有機化合物の合成に頻繁に使用される反応です。 ホウ素三フッ化エテレート-アルコールは、多くのp-アミノ安息香酸、芳香族、複素環および不飽和酸のエステル化のための非常に便利な試薬である。いくつかのエステル化反応において、この試薬の使用は、他の試薬と比較して優れた収率を提供した。 いくつかの例はスキーム8に示されています。 酸30-32は、三フッ化ホウ素エタレートアルコール試薬で処理すると、それぞれエステル33-35に高収率で変換された。 Marshallらはカルボン酸のエステル化に同じ試薬を使用した。 Dymicky22は、三フッ化ホウ素-メタノール錯体の触媒量の存在下でギ酸とアルコールから高収率でいくつかのフォーマットを調製した。 硫酸,p-トルエンスルホン酸などの他の触媒は三フッ化ホウ素-メタノール錯体のように効率的ではなかった。
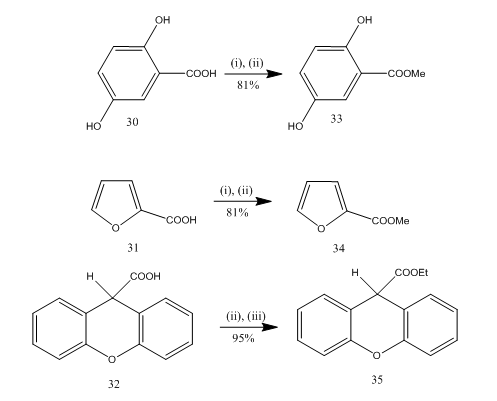
図8酸のエステル化32-35
試薬:(i)MeOH;(ii)BF3.Et2O; (三)エトオ
Jacksonら23は、スキーム9に示されているように、触媒量の三フッ化ホウ素エタレートの存在下で、t-ブチルトリクロロアチミデート36を用いて、アルコール37-39および酸40-42を対応するt-ブチル誘導体に直接変換する効率的な方法を開発した。 この方法はイソブテンを使用する従来の方法より酸の敏感なグループとよく作用します。 ジオールのより少ない妨げられた水酸基は保護することができ、また小規模の仕事に従順です(ガス状イソブテンの渡すことを避けます)。 T-ブチル2,2,2-トリクロロアセトニトリルにt-ブタノールを添加することにより、t-ブチル2,2,2-トリクロロアセトニトリル36を容易に調製することができる。 実験のほとんどはジクロロメタンとシクロヘキサンの混合物の存在下で行った。 ヒドロキシル基のアセチル化のために三フッ化ホウ素の存在下での無水酢酸が利用されている。24

図9t-ブチル誘導体からのアルコールおよび酸の変換。
試薬:36,(i)BF3.Et2O、(ii)Ch2Cl2、C6H12
環化
三フッ化エテレートホウ素は、多くのカルボン酸、アレンなどの環化に重要な役割を果たしてきました。 以下のいくつかの例は、環化剤としての三フッ化エタレートホウ素の役割を説明する。 酸塩化物49とアルケン50を縮合させてジビニルケトン25 51を得、これをナザロフ環化して26、27、28の環状ケトン52を得てセスキテルペン-トリコジエン53に変換した(スキーム10)。
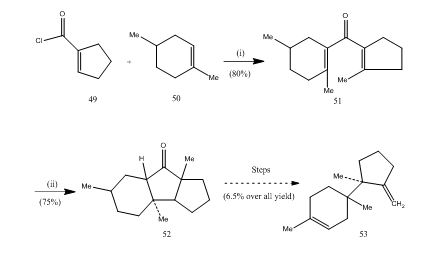
図10セスキテルペントリコジエン53
試薬の合成:(i)Sncl4,NaOMe;(ii)Bf3Et2O
いくつかのアレニルアリールケトンは、新しい5-エンドモード環化を介してメチレンベンゾシクロペンテノンを与える三フッ化ホウ素エタレートと環化を受ける。28ケトン54-56はそれぞれベンゾシクロペンテノン57-59を与えた(スキーム11)。 おそらく、アレニルアリールケトン54から57への環化に示すように変換が起こった。 芳香環中の置換基の存在が環化生成物の収率を決定することが観察され得る。 KosとLoewenthal28は、酸60を三フッ化ホウ素エタレートでケトン61に環化し、ジベロン62(スキーム12)を三段階で変換したことを報告した。:
- ケタ化
- 黄ミンロン還元および
- 酸加水分解。 上記の例は、有機化合物の環化における三フッ化エタレートホウ素の使用を示す
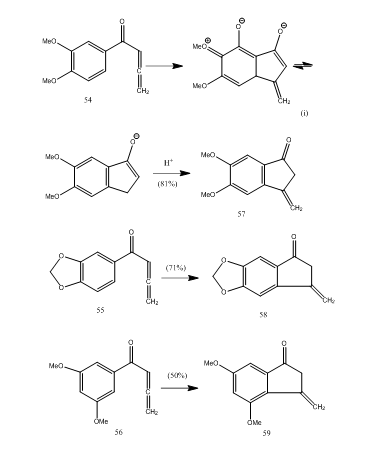
図11シクロペンテノンの合成

図12ジベロンへの合成
試薬:(i)BF3.Et2O;(ii)(a)C2H6O2;(b)DEG,N2H4,KOH,190-200°C;(c)H+