Mo for HF
不均一二原子分子の分子軌道
不均一二原子分子の分子軌道(MO)理論への簡単なアプローチは、エネルギー準位図を示すことです。 MOのエネルギー準位は、次の手順で計算できます。
量子数nのエネルギー\(E_N\)は、原子Zを持つ要素のエネルギーであることを思い出してください。
\
私たちは、核の有効な原子電荷を得るために原子番号を変更しなければならないことを意味するために、Zの代わりに\(Z_{eff}\)を使用します。 近似値を扱っているので、Zを直接使用することができます。 1s軌道エネルギー準位は水素原子の場合-13.6eVであり、Hのイオン化エネルギーとして測定される。
したがって、量子数n=1の場合、Heの1sのエネルギー準位は約-54eVである。 同様に、Fの1sエネルギーレベルは-1101eVです。 Heの2sと2pのエネルギー準位は約-13.6eVであり、これはHの1s軌道のエネルギー準位とほぼ同じである。
したがって、Liの2sのエネルギー準位は約-6eVである。 しかし、多電子原子の場合、pサブシェルとsサブシェルは浸透のために異なるエネルギーを持っています。 このレベルでは、我々はそれについて正確にすることはできませんが、単に2p軌道が2s軌道よりも高いエネルギーにあると考えてください。 通常、互いに類似したエネルギー準位を持つ原子軌道は、分子軌道を形成するために重なり合う。 したがって、我々は原子軌道のエネルギー準位を一致させ、それらの結合および反結合MOsを作る。
しかし、原子軌道のエネルギーレベルが非常に異なる場合には、不完全なサブシェルの原子軌道を使用してMOsを形成します。
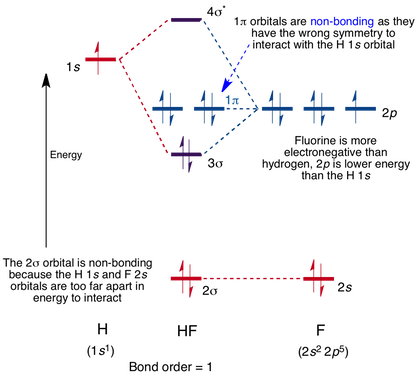
HF分子
の分子軌道図は、水素上の1s軌道とフッ素中の2p軌道の間で相互作用が起こり、以下に示すようにシグマ結合とシグマ反結合分子軌道が形成される。