kaliumchromat
kaliumchromat kemiske egenskaber,anvendelser,produktion
uorganisk forbindelse
kaliumchromat, almindeligvis kendt som tarapacait, er en uorganisk forbindelse, som er gul orthorhombisk eller sekskantet krystal ved stuetemperatur. Den relative densitet er 2,732, og smeltepunktet er 968 liter C. Det er giftigt og kan opløses i vand for at danne alkalisk chromationhydrolyseopløsning. Og det er uopløseligt i alkohol og æter. Efter tilsat syre bliver den gule opløsning af kaliumchromat orange, hvilket er farven på dichromat. Der er en ligevægt mellem omdannelsen af chromat og dichromat i opløsningen: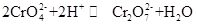
når syren tilsættes til kaliumchromatopløsningen, vil ligevægten skifte mod retningen for generering af kaliumdichromat, og når alkalien tilsættes til kaliumdichromatopløsningen, vil ligevægten skifte til retningen for generering af kaliumchromat. Kaliumchromat har iltningsegenskaber, og det kan reagere med reduktionsmidlet i alkalisk medium til dannelse af Cr(OH)4-(nemlig CrO2-). Tilsætning af forskellige opløsninger indeholdende henholdsvis bariumion, blyion og sølvion til kaliumchromatopløsningen vil danne det tilsvarende uopløselige chromat: bariumchromat BaCrO4 (gul), blykromat pbCrO4 (gul), sølvchromat Ag2CrO4(mursten rød). Og tilstedeværelsen af kromationer kan påvises ved den karakteristiske farve af disse uopløselige kromater. Det kan også bruges til at analysere spor af barium og sølv. Det kan også bruges som råmaterialer til garvning og medicinindustri og andre kromforbindelser. Chromit Fe (CrO2)2 pulver kan anvendes som råmateriale og kalcineres med kaliumhydroksid, kalksten (dolomit) i luften og derefter ekstraheres med kaliumsulfatopløsning for at opnå kaliumchromat.
ovenstående oplysninger er redigeret af Chemicalbook.
Kaliumchromatindikatormetode
Kaliumchromatindikatormetode, også kendt som Moore (Mohr), er en udfældningstitreringsmetode (sølvmetode), der bruger kaliumchromat (K2CrO4) som indikator og sølvnitrat (AgNO3) som standardopløsning. Denne metode anvendes hovedsageligt til bestemmelse af chlorion (Cl-) eller bromidion (Br-). Tilsæt en lille mængde K2CrO4 som indikator, før du angiver bestemmelse, og titrer derefter med AgNO3 standardopløsning. Efter starten af titreringen udfældes bundfaldet af hvidt (sølvchlorid) eller lysegult (sølvbromid) først. Når Cl – eller Br-udfældes kvantitativt, vil en lille overskydende sølvnitratopløsning medføre, at koncentrationen af Ag+ pludselig øges for straks at generere murstenrød sølvchromat (Ag2CrO4) udfældning, hvilket indikerer titreringsendepunktet. Mængden af indikator og opløsningens surhed er to store problemer med denne titreringsmetode. Hvis k2cro4-koncentrationen er for høj, vil farven på titreringsopløsningen være for dyb til at hindre observationen af Ag2CrO4-udfældningsfarve til sidst; hvis k2cro4-koncentrationen er for lav, vil der være behov for en alt for betydelig mængde sølvnitratopløsning efter den kvantitative udfældning af sølvhalogenid for at generere sølvkromatudfældning for at instruere titreringsendepunktet, hvilket vil medføre, at titreringsfejlen øges. Når 0,1 mol/l AgNO3-opløsningen bruges til at titrere 0.1mol / l halogenid, hvis koncentrationen af K2CrO4 er 5 liter 10-3mol/l, er slutpunktsfejlen kun +0,06%, hvilket kan antages, at nøjagtigheden af analyseresultatet ikke påvirkes. K2cro4-indikatormetoden kan ikke udføres i sur eller alkalisk opløsning, fordi K2CrO4 omdannes til kaliumdichromat (K2Cr2O7) ved en lille pH-værdi, og Ag+ udfældes i form af Sølvoksid (Ag2O), når pH er for høj. Almindeligvis er det egnede surhedsområde pH = 6,5~ 10,5, men når der er ammoniumsalte i opløsning, er opløsningens surhedsgrad pH = 6,5~7,2 passende.
kaliumchromatindikatmetoden kan kun anvendes til direkte titrering af Cl-eller Br-ioner, og titreringsresultatet er deres samlede, når de eksisterer sammen. Denne metode er ikke egnet til bestemmelse af iodidion (i-) eller thiocyanation (SCN-), fordi de absorberes for let ved sedimentering, og slutpunktet er uklart. Denne metode er heller ikke egnet til titrering af Ag+ med Cl-, men Ag+ kan bestemmes ved hjælp af bagtitreringen, nemlig tilsæt en for stor mængde NaCl-standardopløsning i testopløsningen, og brug derefter AgNO3-standardopløsning til at titrere overskydende Cl-ioner. I opløsningen vil alle kationer, der kan danne bundfald med CrO2-4 eller de anioner, der kan udfældes med Ag+, forstyrre bestemmelsen. Kaliumchromatindikatmetoden anvendes hovedsageligt til bestemmelse af Cl-ionerne i meget fortyndet opløsning, såsom bestemmelse af Cl-i drikkevand og industriprodukter urenheder.
kaliumdichromat
kaliumdichromat, også kendt som rød alunkalium, er orange-rød triclinisk krystal eller nålelignende krystal. Tætheden er 2,676 g / cm3. Smeltetemperaturen er 398 liter C. Det er opløseligt i vand og uopløseligt i ethanol. Det har en stærk iltningsegenskab og nedbrydes ved 1300 liter C.
i produktion bruges kaliumdichromat altid til at introducere krom for at gøre emaljen farvet ved smeltning. Det er farvestoffet af farvet titanium mælk gul glasur og titanium gul glasur, og den anvendte dosering er generelt 0,06%~0,12%. Kaliumdichromat og kobber kan også blandes-bruges til at opnå grøn, bambusgrøn, frugtgrøn og anden farveglasur. Imidlertid er disse farvede glasurer generelt mindre blanke på grund af påvirkning af chromat.
farveglasuren opnået fra kromoksid eller kaliumdichromat (natrium) er ofte gulgrøn på grund af valensændringen af kromioner i smelteprocessen. Kaliumdichromat bruges også ofte til at fremstille forskellige grønne pigmenter og lyserøde pigmenter.
kaliumdichromat skal opfylde de krævede mål: kaliumdichromatindhold på 99%, chlorid (Cl) – indhold på 0,08%, vanduopløseligt på 0,05%.
ovenstående oplysninger er udarbejdet af Yaoyao fra Chemicalbook.
opløselighed i vand (g/100ml)
opløst gram pr. 100 ml vand ved forskellige temperaturer (liter C):
60 g/10 °C; 63.7 g/20 °C; 66.7 g/30 °C; 67.8 g/40 °C
70.1 g/60 °C; 74.5 g/90 °C
Toksicitet
Se natriumchromat
Kemiske egenskaber
Citron gul orthorhombic krystal; Opløseligt i vand, uopløseligt i alkohol
Anvendelse
Brugt som analysekvalitet, oxiderende, hårde og metal rust hæmmer;anvendes til fremstilling af chromat,der anvendes som oxidant og bejdsemiddel af trykning og farvning. Anvendes til blæk, maling, emalje,metalkorrosion og så videre, hovedsagelig anvendt til fremstilling af kemiske reagenser og pigmenter.
forberedelse
Neutraliseringsmetode: Opløs kaliumdichromat i moderluden og vandet, og tilsæt derefter blandingen til reaktoren. Derefter tilsættes kaliumhydroksid under omrøring for at udføre neutraliseringsreaktion. Det producerede kaliumchromat er svagt alkalisk og inddampes derefter til koncentration, afkøles til krystallisation, separeres og tørres for at opnå de færdige kaliumchromatprodukter.
K2Cr2O7 + 2KOH liter 2k2cro4 + H2O
den adskilte moderlud vil blive returneret til opløsningstrinnet til opløsning af kaliumdichromat.
kemiske egenskaber
citrongule krystaller
kemiske egenskaber
kaliumchromat(VI) er et gult krystallinsk fast stof.
anvendelser
kaliumchromat (K2CrO4) er opløseligt i vand og bruges til at fremstille lyse gule blækog malingspigmenter. Det bruges også som reagens i kemiske laboratorier og som mordant til at”fikse” farvestoffer i farvede tekstiler.
bruger
det bruges som et iltningsmiddel.
anvendelser
har en begrænset anvendelse i emaljer, efterbehandling læder, rustbeskyttelse af metaller, erstattes af natriumsaltet; som reagens i analytisk kemi.
Definition
ChEBI: et kaliumsalt bestående af kalium-og chromationer i forholdet 2:1.
Definition
et salt indeholdende ionCrO42-.
Definition
kaliumchromat: en lysegulkrystallinsk fast stof, K2CrO4, opløselig i vand og uopløseligt i alkohol;rhombic; r.D. 2.73; m.p. 968.3 liter C; nedbrydes uden kogning. Den fremstilles industrielt ved ristning af pulverkromitmalm med kaliumhydroksid og kalksten og udvaskning af den resulterende cinder med varmkaliumsulfatopløsning. Kaliumkromat anvendes i læderefterbehandling, som en Tekstil mordant, og inenamels og pigmenter. I laboratorietdet bruges som en analytiskreagent og som indikator. Ligesomandre chrom (III) forbindelser er detgiftigt, når det indtages eller indåndes.
generel beskrivelse
kaliumchromat er et gult krystallinsk fast stof. Kaliumchromat er opløseligt i vand. Den primære fare er truslen mod miljøet. Øjeblikkelige skridt bør tages for at begrænse dets spredning til miljøet. Kaliumchromat anvendes til kemisk analyse, til fremstilling af pigmenter til maling og blæk, som et fungicid og til fremstilling af andre kromforbindelser.
luft & Vandreaktioner
opløseligt i vand.
Reaktivitetsprofil
iltningsmidler, såsom kaliumchromat , kan reagere med reduktionsmidler for at generere varme og produkter, der kan være gasformige (forårsager tryk på lukkede beholdere). Produkterne kan selv være i stand til yderligere reaktioner (såsom forbrænding i luften). Den kemiske reduktion af materialer i denne gruppe kan være hurtig eller endog eksplosiv, men kræver ofte initiering (varme, gnist, katalysator, tilsætning af et opløsningsmiddel). Eksplosive blandinger af uorganiske iltningsmidler med reduktionsmidler forbliver ofte uændrede i lange perioder, hvis initiering forhindres. Sådanne systemer er typisk blandinger af faste stoffer, men kan involvere enhver kombination af fysiske tilstande. Nogle uorganiske iltningsmidler er salte af metaller, der er opløselige i vand; opløsning fortynder, men annullerer ikke iltningskraften i sådanne materialer. Organiske forbindelser har generelt en vis reducerende effekt og kan i princippet reagere med forbindelser i denne klasse. Faktisk reaktivitet varierer meget med identiteten af den organiske forbindelse. Uorganiske iltningsmidler kan reagere voldsomt med aktive metaller, cyanider, estere og thiocyanater.
fare
Giftig ved indtagelse og indånding.
sundhedsfare
indånding forårsager lokal irritation af slimhinder; fortsat næseirritation kan resultere i perforering af næseseptum. Indtagelse kan forårsage voldelig gastroenteritis, kredsløbskollaps, svimmelhed, koma og giftig nefritis; indtagelse af for store mængder kan være dødelig. Kontakt med øjne forårsager alvorlig irritation og konjunktivitis. Gentagen eller langvarig udsættelse for støv, tåge eller opløsninger kan forårsage dermatitis; kontakt med brud i huden kan forårsage `kromsår”, der fremstår som langsomt helende, hårdt rimmede sår, der efterlader området sårbart over for infektion.
brandfare
opførsel i brand: kan øge brandintensiteten, hvis den er i kontakt med brændbare materialer. Cool beholdere og spildt materiale med rigeligt vand.
sikkerhedsprofil
bekræftet carcinogenmed eksperimentelle tumorigene data. Forgiftning ved indtagelse, intravenøs, subkutan ogintramuskulære ruter. Et eksperimenteltteratogen. Andre eksperimentelle reproduktivevirkninger. Humane mutationsdata rapporteret. En kraftig iltningsmiddel. Ved opvarmning tildekomposition udsender det giftige dampe af K2O. anvendes som mordant til uld, i iltningog behandling af farvestoffer på materialer. Se ogsåchromiumforbindelser.
potentiel eksponering
kaliumchromat anvendes til udskrivning: fotomekanisk behandling; chrom-pigment produktion; og uld konserveringsmiddel metoder; at gøre farvestoffer, pigmenter, blæk og emaljer; som et iltningsmiddel; analytisk reagens; i galvanisering; sprængstoffer.
forsendelse
UN1479 brandnærende fast stof, n.o.s., fareklasse: 5.1; etiketter: 5.1-brandnærende, teknisk navn påkrævet. UN3288 giftige faste stoffer, uorganiske, n. o. s., fareklasse: 6.1; etiketter: 6.1-giftige materialer, teknisk navn påkrævet
rensningsmetoder
Krystalliser det fra ledningsevne vand (0,6 g/mL ved 20o), og tør det mellem 135o og 170o.
uforligeligheder
en kraftig iltningsmiddel. Voldelige reaktioner med brændbare stoffer, organiske stoffer, pulveriserede metaller; eller let iltbare stoffer. Kontakt med hydroksylamin, hydrasin forårsager eksplosion.