인플루엔자 바이러스의 뉴 라미니다 제
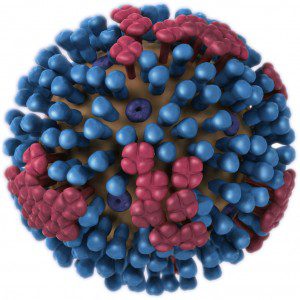 인플루엔자 바이러스 입자는 지질막에 싸인 바이러스 게놈으로 구성됩니다(예시). 막 또는 외피에는 세 가지 종류의 바이러스 단백질이 포함되어 있습니다. 헤 마글 루티 닌 분자(하,파란색)는 세포 수용체에 부착되어 세포로 바이러스가 들어가는 과정을 시작합니다. 나는 감염 중 하와 그 기능(기사 1 과 2)에 대해 작성했지만 뉴 라미니다 제(나,적색)또는 미디엄 2(보라색)단백질에 대해서는 작성하지 않았습니다. 의 첫 번째 노나 해결하자.
인플루엔자 바이러스 입자는 지질막에 싸인 바이러스 게놈으로 구성됩니다(예시). 막 또는 외피에는 세 가지 종류의 바이러스 단백질이 포함되어 있습니다. 헤 마글 루티 닌 분자(하,파란색)는 세포 수용체에 부착되어 세포로 바이러스가 들어가는 과정을 시작합니다. 나는 감염 중 하와 그 기능(기사 1 과 2)에 대해 작성했지만 뉴 라미니다 제(나,적색)또는 미디엄 2(보라색)단백질에 대해서는 작성하지 않았습니다. 의 첫 번째 노나 해결하자.
나 단백질의 중요한 기능은 당 단백질으로부터 시알 산을 제거하는 것이다. 시알 산은 많은 세포 표면 단백질 뿐 아니라 바이러스성 당 단백질에 출석합니다;유행성감기 바이러스가 헥타르 단백질을 통해 붙이는 세포 수용체입니다. 하 및 노나에 시알 산은 단백질이 분비 통로를 통해서 세포 표면으로 이동하는 때 제거됩니다. 새로 출시 된 바이러스 입자는 여전히 잠재적으로 세포 표면에 존재하는 시알 산에 하의 결합에 의해 집계 할 수 있습니다. 몇 년 전 피터 팔레 즈 바이러스 성 뉴 라미니다 아제가 비활성화 될 때 인플루엔자 바이러스가 세포 표면에 응집체를 형성한다는 것을 보여주었습니다. 노나 따라서 감염된 세포의 표면에서 자손 바이러스 입자의 방출을 위해 필수적인 효소이다.
나 단백질은 또한 바이러스가 호흡기로 들어가는 동안 기능한다. 호흡기의 상피 세포는 많은 시알 산 함유 당 단백질을 포함하는 복잡한 보호 코팅 인 점액으로 목욕됩니다. 인플루엔자 비리 온이 호흡기로 들어갈 때,그들은 시알 산을 묶는 점액에 갇혀 있습니다. 이 상호 작용은 바이러스가 감염되기 쉬운 세포에 결합하는 것을 막을 것입니다 당 단백질에서 시알 산을 자르는 나 단백질의 활동을 위해 아닙니다. 바이러스 입자가 세포를 만날 때,시알 산 포함 수용체를 묶고 나 단백질이 세포 표면에서 탄수화물을 쪼갤 수 있기 전에 세포로 급속하게 가지고 갑니다.
바이러스 방출을 억제하기 위한 신약 개발에 바이러스 생산을 위한 노바이러스의 본질적 특성이 이용되어 왔다. 타미플루(오셀 타미 비르)와 리렌자(자 나미 비르)는 나 효소의 활성 부위에 단단히 결합하는 시알 산의 구조적 모방입니다. 약물에 결합 할 때,노나 세포 표면에서 시알 산을 제거 할 수 없습니다,결과적으로 새로 합성 된 바이러스는 고정 상태로 유지. 그 결과 비리 온이 한 세포에서 다른 세포로 퍼질 수 없기 때문에 바이러스 감염이 억제됩니다.
이 기사는 인플루엔자 바이러스 생물학 및 병인에 관한 일련의 게시물 인 인플루엔자 101 의 일부입니다.