크리에이 티브 프로테오믹스 블로그
단백질 또는 펩타이드 내의 아미노산 서열은 페르 에드만에 의해 개발된 에드만 분해에 의해 확인될 수 있다. 이 방법은 다른 아미노산 잔기 사이의 펩타이드 결합을 방해하지 않고 엔 말단에서 펩타이드를 라벨링하고 절단 할 수 있습니다. 에드먼 분해 반응은 1967 년에 에드먼과 베그스에 의해 자동화되었습니다. 요즘에는 자동화 된 에드만 분해(단백질 서열 화기)가 널리 사용되며 펩타이드를 최대 50 개의 아미노산으로 서열화 할 수 있습니다.
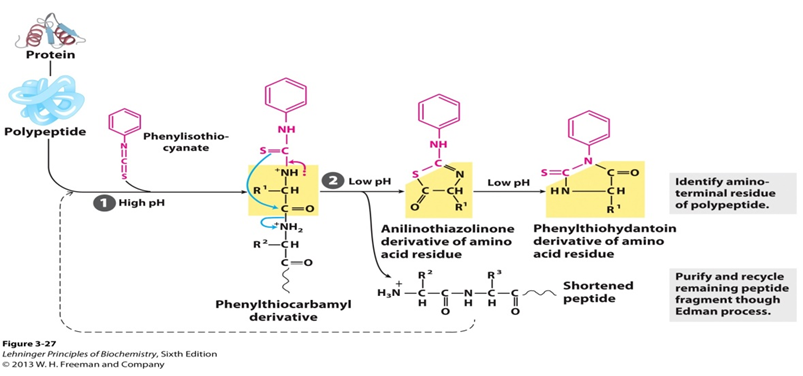
페닐 이소 티오 시아 네이트와 유리 아미노기의 반응에 기초한 펩타이드의 주기적 분해 엔-말단 잔기 이러한 아미노산은 한 번에 하나씩 제거되고 그들의 페닐 티오 히단토인 유도체로 확인된다. 페닐 티오 카르 바 모일 유도체를 제공하기 위해 약간 알칼리성 조건 하에서 아미노 말단에서 페닐 이소 티오 시아 네이트와 반응한다. 그런 다음 산성 조건 하에서 유도체의 티오 카르 보닐 황은 엔-말단 아미노산의 카르 보닐 탄소를 공격합니다. 첫 번째 아미노산은 아닐리노티아졸리논 유도체(아츠-아미노산)로서 절단되고,나머지 펩타이드는 분리될 수 있고 다음 분해 사이클에 복종될 수 있다. 일단 형성되면,이 티아 졸론 유도체는 페닐 티오 카르 바밀 유도체보다 더 안정하다. 그런 다음 에틸 아세 레이트로 추출하여 아미노산을 제거하고 페닐 티오 히단 토인 유도체로 전환시킵니다. 그리고 크로마토그래피를 사용하여 각 사이클에 의해 생성된 크로마토그래피 잔여물을 식별할 수 있다.
자동화된 에드먼 분해에 관해서는,단백질들을 용액에 티파파 필터에 적용한 후 에드먼 시퀀싱 기기에 로드하여 분석할 수 있다. 혼합물 내의 단백질은 먼저 1 차원 또는 2 차원 겔에 의해 분리된 후,폴리프로필렌 막 상에 도말된다. 쿠마시에 블루,아미도 블랙 또는 폰카우 염색에 의해 단백질이 검출되고,관심 있는 단백질을 잘라내어 에드먼 시퀀서에 로드된 멤브레인 피스가 검출됩니다.
질량 분석법이 개발되면서 에드만 분해 시퀀싱의 사용이 감소하기 시작했다. 그러나,그것은 아직도 단백질 구조 분석 응용 프로그램의 여러 종류에 대 한 방법 남아 있다. 특히 단백질 또는 도메인이>40 내지 80 이거나 쉽게 정제될 수 없을 때,재조합 단백질의 엔-말단 경계를 확인하거나 프로테아제 내성 도메인의 엔-말단을 결정하는 데 사용될 수 있다. 또한 단백질 단편에서 새로운 엔-말단 및 단백질 분해 절단 부위를 식별하는 데 사용할 수 있습니다. 또한,서열 데이터베이스가 밀리/밀리 데이터베이스 검색을 위해 이용 가능하지 않은 일부 신규한 단백질 및 펩타이드에 관해서는,에드먼 분해가 분석을 위해 사용될 수 있다.
단백질의 엔-말단 아미노산은 절단될 수 있다. 따라서,공정에서,제 1 사이클은 따라서 정확한 엔-말단 아미노산을 식별한다. 또한,방출된 아미노산이 크로마토그래피에 의해 확인되고 정량화되기 때문에,동일한 분자량을 갖는 아미노산이 확인될 수 있다. 예를 들어,이소류신과 류신은 113 다의 질량을 가지고 있지만,그들은 다른 보존 시간을 가지고있다. 또한,에 드만 시퀀싱에서 수행할 수 있습니다. 그러나 에드먼 분해 시퀀싱은 아세틸 화와 같이 화학적으로 변형 된 펩타이드가 엔-말단 인 경우 사용할 수 없습니다. 그리고 피츠키가 비-아미노산-아미노산과 반응할 수 없기 때문에,비-아미노산-아미노산이 이소아스파르트 산처럼 마주치면 시퀀싱은 멈출 것이다. 또한,더 큰 단백질은 에드 먼 시퀀싱에 의해 서열화 될 수 없다.
크리에이 티브 프로테오믹스에서 우리의 전문 단백질 시퀀싱 플랫폼 에 드만 저하 또는 질량 분석(밀리)에 의해 엔 터미널 시퀀스 분석을 제공 합니다. 광범위한 경험을 가진 전문가의 우리의 팀은 당신이 조사하고 요구 사항을 충족하기 위해 노력하고있는 것을 이해하는 데 도움이 될 수 있습니다. 또한 다음을 포함한 다른 단백질 식별 서비스를 제공 할 수 있습니다:
- 펩티드 또는 단백질의 서열 분석
- 드노보 단백질 서열 분석 서비스
- 산탄총 단백질 식별 서비스
- 막 단백질체학 서비스