퇴화의 정의
퇴화는 양자 역학에서’동등한 에너지’를 의미하는 데 사용됩니다.’일반적으로 전자 에너지 레벨 또는 하위 레벨을 나타냅니다.
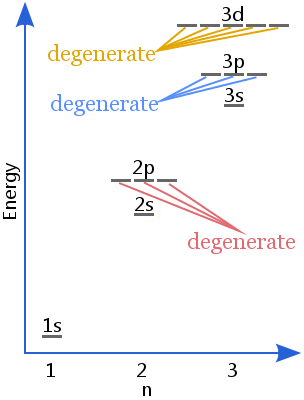
예를 들어,2 피 하위 레벨의 궤도는 퇴화됩니다.이 궤도는 1545 에서 1545 에서 1545 에서 1545 에서 1545 사이입니다.그 결과,이 두 가지 유형의 에너지 중 하나가 생성되고,이 두 가지 유형의 에너지 중 하나가 생성된다.
동등한 에너지의 다른 상태의 수를 퇴행의 정도 또는 단지 퇴행이라고합니다.
피 궤도의 퇴행은 3,디 궤도의 퇴행은 5,에프 궤도의 퇴행은 7 이다.
우리는 또한 전자를 비교할 수 있습니다 energies.In 수소 원자 에너지 준위의 다음 다이어그램은 전자가 퇴화됩니다.
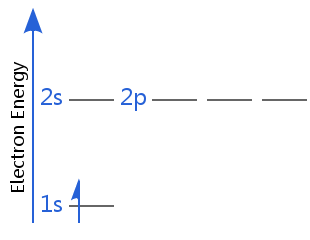
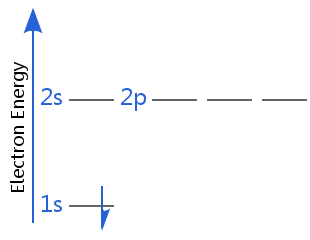
전자 중 하나는 스핀 업이고 다른 하나는 spin-down.In 비 균일 자기장,다른 스핀은 다르게 반응합니다; 다른 스핀 방향을 가진 전자는 더 이상 퇴화되지 않을 것입니다-그들은 약간 다른 양의 에너지를 가질 것입니다.이것이 1922 년 스턴-겔라흐 실험에 의해 전자 스핀이 처음 발견 된 방법입니다.
이 두 다이어그램에서도 2 초와 2 피 하위 수준이 퇴화되었음을 알 수 있습니다. 이것은 수소 원자 및 이온,즉 하나의 전자 만 가진 이온의 경우입니다.
