MO for HF
molekylære orbitaler for heterogene diatomiske molekyler
en simpel tilgang til molekylær orbital (MO) teori for heterogene diatomiske molekyler er at vise energiniveaudiagrammet. Mo-energiniveauerne kan udarbejdes ved at følge disse trin:
Husk at energien \(E_n\) for kvantetallet n er for et element med Atom
\
vi bruger \(Å_{eff}\) i stedet for å for at betyde, at vi er nødt til at ændre atomnummeret for at få en effektiv atomladning for kernen. Da vi har at gøre med omtrentlige værdier, kan man bruge å direkte. 1s orbital energiniveau er -13,6 eV for hydrogenatomer, målt som ioniseringsenergien af H.
for kvantetallet n = 1 er energiniveauet for 1s af He ca. – 54 eV. Tilsvarende er 1s energiniveauet for F-1101 eV. 2s og 2p energiniveauer for He er ca. – 13,6 eV, hvilket er simlar til 1s orbital af H.
således er 2s energiniveauet for Li ca.-6 eV. For multi-elektronatomer har p-subshell og s-subshell imidlertid forskellige energier på grund af penetration. På dette niveau kan vi ikke være præcise om det, men tror simpelthen, at 2P-orbitalerne har højere energi end 2s-orbitalen. Normalt vil atomorbitaler med energiniveauer svarende til hinanden overlappe hinanden for at danne molekylære orbitaler. Således matcher vi energiniveauerne af atomorbitaler og laver derefter binding og anti-binding MOs af dem.
men hvis atomar orbital energiniveauet er meget anderledes, bruger vi atomorbitaler af den ufuldstændige subshell til at danne MOs.
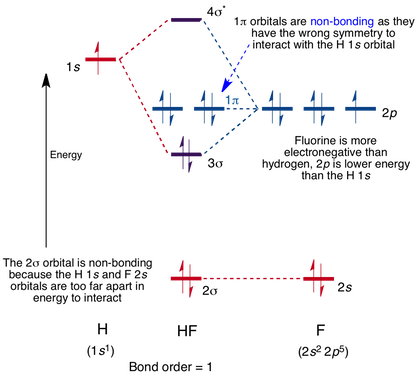
molekylært Orbitaldiagram for HF-molekylet
interaktion forekommer mellem 1s-orbitalen på hydrogen og 2p-orbitalen i fluor, der forårsager dannelsen af en sigma-binding og en sigma-antibinding molekylær orbital, som vist nedenfor.