Molekylær struktur afslører, hvordan antibiotikumet Streptomycin virker | BNL nyhedsrum
molekylær struktur afslører, hvordan antibiotikumet Streptomycin virker
5.September 2013
Streptomycin var det første antibiotikum udviklet til behandling af tuberkulose endnu indtil for nylig forstod forskerne ikke helt, hvordan det virker på molekylært niveau. De vidste, at streptomycin blokerer en kritisk proces, syntesen af proteiner ved ribosomer, der fører til bakteriecelledød, men visse detaljer om interaktionen forblev uopdagede. På Brookhaven National Laboratory ‘ s National Synchrotron lyskilde har forskere brugt røntgenkrystallografi til at fuldføre billedet.
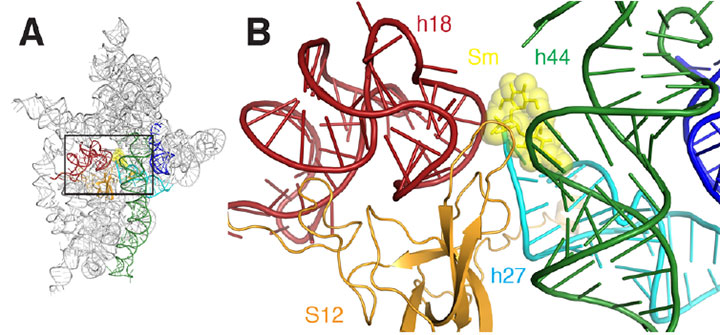
A) et bånddiagram over ribosomets streptomycinbindingssted. B) et nærbillede af det rektangulære område skitseret i A. Streptomycin er repræsenteret som gule sHcks og kugler, spiraler er farvet rød, mørkegrøn, cyan, orange og blå.
Streptomycin er medlem af en familie af antibiotika, der virker ved at afbryde funktionen af bakteriecellernes ribosomer, de komplekse molekylære maskiner, der skaber proteiner ved at forbinde aminosyrer sammen. Ribosomer, et vigtigt mål for antibiotika, der virker ved at hæmme syntesen af proteiner, har to hoveddele eller “underenheder.”
den større underenhed gør proteinopbygningen, styret af en type RNA kaldet messenger RNA (mRNA), som binder til det. Den lille underenhed “læser” mRNA ‘ et og vælger det matchende transfer RNA (tRNA) molekyle, som vælger og leverer den næste aminosyre til ribosomet. Det er her streptomycin spiller en rolle. Det binder tæt på den lille underenhed, hvilket får den til at forkert læse sekvensen alvorligt. Dette resulterer i syntesen af tilfældige proteiner, som i sidste ende dræber bakterierne. Men hvordan denne fejllæsning fandt sted forblev et mysterium, indtil en nylig undersøgelse foretaget af forskere fra Det Brune Universitet og multi-institution Northeastern Collaborative Access Team ved Argonne National Laboratory (administreret af Cornell University).
ved at skabe en krystal – en ordnet struktur af identiske enheder – af den lille ribosomale underenhed bundet til mRNA i nærvær af streptomycin, genererede forskerne flere detaljerede “snapshots”, der afslørede vigtige detaljer på molekylært niveau af interaktionen, hvilket i sidste ende viser, hvordan streptomycin forringer underenhedens funktion. På NSLS beamline H25 brugte de en teknik kaldet røntgenkrystallografi, hvor en stråle af røntgenstråler er rettet mod krystallen, interagerer med molekylerne og giver et indviklet diffraktionsmønster. Fra mønsteret konstruerede gruppen ved hjælp af computerprogrammer visuelle repræsentationer af underenheden-mRNA-streptomycinkomplekset.
kort sagt kunne forskerne “se” for første gang de subtile måder, hvorpå streptomycin fordrejer strukturen på underenhedens dekodningssted, hvilket får det til at læse mRNA forkert. For eksempel reducerer streptomycinbinding afstanden mellem to af de mange helices, der udgør underenhedens molekylære struktur. Dette er især vigtigt, fordi disse helices danner det faktiske afkodningssted, og afkodning finder kun sted korrekt, hvis disse elementer er orienteret nøjagtigt i forhold til mRNA og det valgte tRNA. Streptomycinbinding inducerer også en ændring i forholdet mellem en af disse to spiraler og en tredje spiral, hvilket får den ene til at trække sig tilbage fra den anden eller “løsne sig.”
slutresultatet af alle disse små ændringer er, at streptomycin destabiliserer bindingen mellem underenheden og den” korrekte “tRNA samtidig med at den stabiliserer bindingen af underenheden til den” forkerte ” tRNA og derved effektivt fjerner diskriminationen mellem den korrekte og den forkerte tRNA. Dette forårsager kaos i bakterieforsyningskæden for nye proteiner, hvilket forstyrrer bakteriens reproduktion og livscyklus.
” vores strukturelle undersøgelser afslørede, at streptomycin inducerer overraskende store forvrængninger i bakterieribosomet, som hjælper os med at forstå, hvordan dette antibiotikum interfererer med proteinsyntese i bakterier,” siger ledende forsker Gervald Jogl, lektor i biologi i brun Molekylærbiologi, cellebiologi & biokemi afdeling. “Fortsat fra vores nuværende fund undersøger vi nu, hvordan mutationer i bakterielle ribosomer kan modvirke disse strukturelle omlejringer og gøre det muligt for bakterier at overleve den ellers dødelige virkning af streptomycin.”
denne forskning blev offentliggjort i 15. januar 2013-udgaven af Nature Communications under titlen ” et strukturelt grundlag for streptomycin-induceret fejllæsning af den genetiske kode.”Støtten kom fra National Institutes of Health og Department of Energy.
2013-4251/INT | ekst / nyhedsrum