18.6: Reaksjoner Av Epoksider: Ringåpning
Epoksyd ringåpningsreaksjoner-SN1 vs. SN2, regioselektivitet og stereoselektivitet
de ikke – enzymatiske ringåpningsreaksjonene av epoksider gir en fin oversikt over mange av konseptene vi allerede har sett i dette kapitlet. Ringåpningsreaksjoner kan fortsette MED ENTEN SN2-eller SN1-mekanismer, avhengig av epoksydets natur og reaksjonsbetingelsene. Hvis epoksidet er asymmetrisk, vil strukturen av produktet variere i henhold til hvilken mekanisme dominerer. Når et asymmetrisk epoksid gjennomgår solvolyse i basisk metanol, oppstår ringåpning ved EN SN2-mekanisme, og det mindre substituerte karbonet er stedet for nukleofil angrep, noe som fører til det vi vil referere Til som produkt B:

Omvendt, når solvolyse forekommer i sur metanol, skjer reaksjonen ved en mekanisme med betydelig SN1 karakter, og jo mer substituert karbon er angrepsstedet. Som et resultat dominerer produkt A.

dette er begge gode eksempler på regioselektive reaksjoner. I en regioselektiv reaksjon er to (eller flere) forskjellige konstitusjonelle isomerer mulige som produkter, men en dannes fortrinnsvis (eller noen ganger utelukkende).
la oss undersøke det grunnleggende SN2-tilfellet først. Leaving gruppen er en alkoxide anion, fordi det er ingen syre tilgjengelig for å protonere oksygen før ringen åpningen. En alkoksyd er en dårlig forlater gruppe, og dermed ringen er usannsynlig å åpne uten en ‘push’ fra nucleophile.
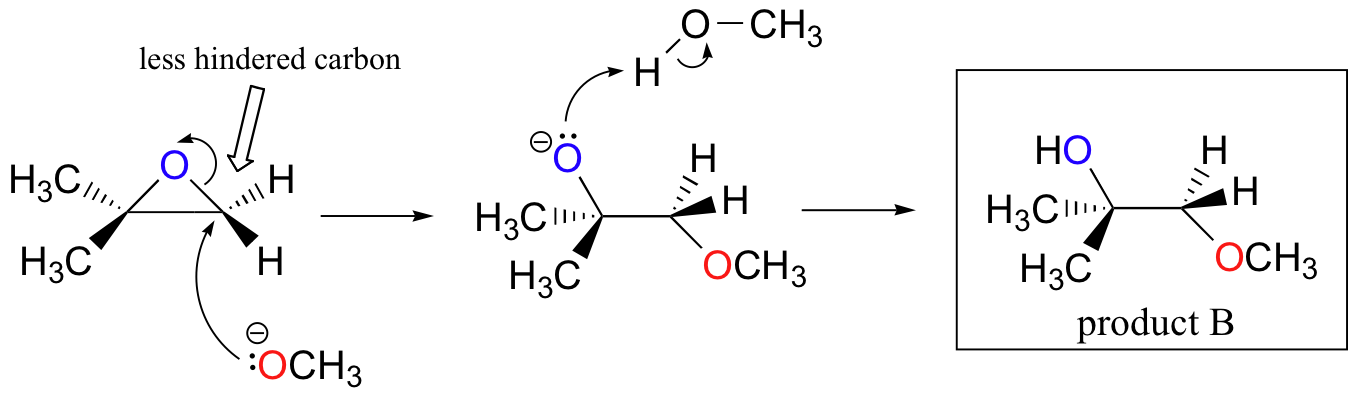
nukleofilen i seg selv er potent: et deprotonert, negativt ladet metoksidion. Når en nukleofil substitusjonsreaksjon innebærer en dårlig forlatelsesgruppe og en kraftig nukleofil, er DET svært sannsynlig å fortsette med EN SN2-mekanisme.
hva med elektrofilen? Det er to elektrofile karboner i epoksidet, men det beste målet for nukleofilen i EN SN2-reaksjon er karbonet som er minst hindret. Dette står for det observerte regionokjemiske resultatet. Som i ANDRE SN2-reaksjoner finner nukleofil angrep sted fra baksiden, noe som resulterer i inversjon ved det elektrofile karbonet.
Sannsynligvis Den beste måten å skildre syre-katalysert epoxide ring-åpning reaksjon er som en hybrid, eller kryss, MELLOM EN SN2 OG SN1 mekanisme. Først protoneres oksygenet, noe som skaper en god forlatingsgruppe (trinn 1 nedenfor). Så begynner karbon-oksygenbindingen å bryte (trinn 2) og positiv ladning begynner å bygge opp på det mer substituerte karbonet (husk diskusjonen fra seksjon 8.4 B om karbokaliseringsstabilitet).

I Motsetning TIL I EN SN1-reaksjon angriper nukleofilen det elektrofile karbonet (trinn 3) før et komplett karbokasjonsmiddel har en sjanse til å danne seg.
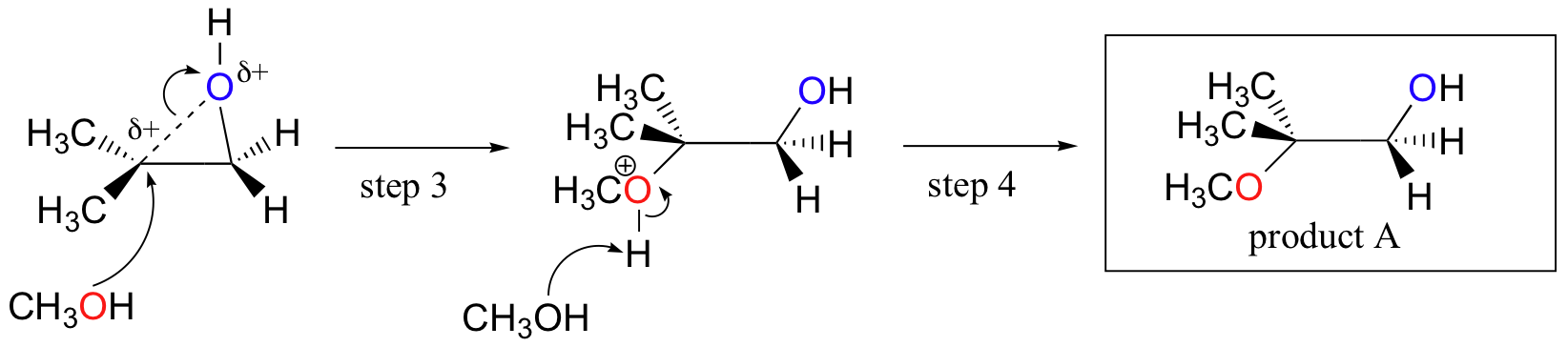
Angrep foregår fortrinnsvis fra baksiden (som I EN SN2-reaksjon) fordi karbon-oksygenbindingen fortsatt til en viss grad er på plass, og oksygenblokkene angriper fra forsiden. Legg merke til, derimot, hvordan den regiochemical utfallet er forskjellig fra base-katalysert reaksjon: i den syre-katalyserte prosessen angriper nukleofilen det mer substituerte karbonet fordi det er dette karbonet som har en større grad av positiv ladning.
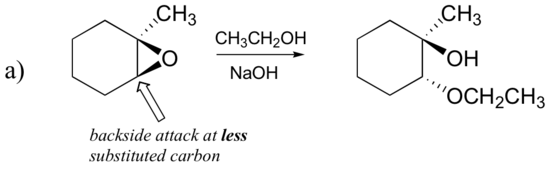
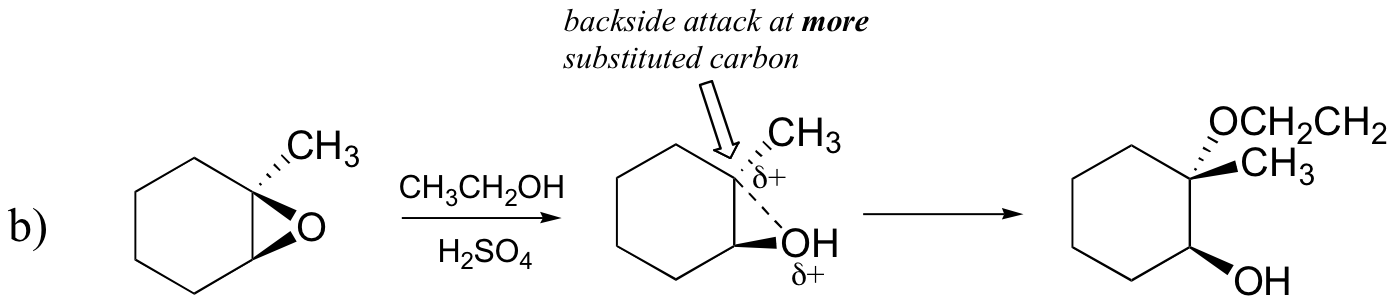
Eksempel 18.6.1
Forutsi hovedproduktet (- ene) av ringåpningsreaksjonen som oppstår når epoksidet vist nedenfor behandles med:
- etanol og en liten mengde natriumhydroksid
- etanol og en liten mengde svovelsyre
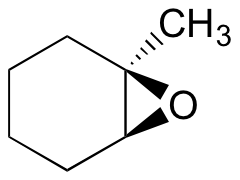
Hint: pass på å vurdere både regiochemistry og stereochemistry!
Svar