ATrain Utdanning
selv om vi lærer mer hver dag om patofysiologien Av Parkinsons sykdom, er det fortsatt ansett i stor grad idiopatisk (av ukjent årsak). Det innebærer sannsynligvis samspillet mellom vertsfølsomhet og miljøfaktorer. En liten prosentandel av tilfellene er genetisk knyttet og genetiske faktorer blir intensivt studert.
Fysiologisk er symptomene forbundet Med Parkinsons sykdom resultatet av tap av en rekke nevrotransmittere, spesielt dopamin. Symptomene forverres over tid ettersom flere og flere av cellene som er berørt av sykdommen, går tapt. Forløpet av sykdommen er svært variabel, med noen pasienter som viser svært få symptomer når de blir eldre og andre hvis symptomer utvikler seg raskt.
Parkinsons blir i økende grad sett på som en kompleks nevrodegenerativ sykdom med en sekvens av progresjon. Det er sterke bevis på at det først påvirker dorsal motor kjernen av vagus nerve og olfactory pærer og kjernen, deretter locus coeruleus, og til slutt substantia nigra. Kortikale områder av hjernen påvirkes senere. Skader på disse ulike nevrale systemene står for de mangfoldige patofysiologiske endringene som forårsaker forringelser, ikke bare for motorsystemet, men også for de kognitive Og nevropsykologiske systemene (Kwan & Whitehill, 2011).
Dopaminens Rolle
Dopamin, som andre nevrotransmittere, overfører kjemiske meldinger fra en nervecelle til en annen over synapsen, et mellomrom mellom den presynaptiske cellen og den postsynaptiske reseptoren. Dopamin utskilles i synapsen fra membranlagringsvesikler i presynaptisk membran. Den krysser synapsen og binder seg til den postsynaptiske membranen, hvor den aktiverer dopaminreseptorer. Ubrukt dopamin som er igjen i synapsen, absorberes tilbake i presynaptisk celle; en gang tilbake i presynaptisk celle, blir overskytende dopamin ompakket i lagringsvesikler og frigjort igjen i synapsen.
i synapsen, da dopamin beveger seg fra en celle til en annen, kan den brytes ned og gjøres inaktiv av to enzymer, MAO (monoaminoksidase) og COMT (katekol-o-metyltransferase). En terapeutisk strategi introduserer EN MAO-hemmer i synapsen, som forstyrrer VIRKNINGEN AV MAO-enzymet og forhindrer nedbrytning av dopamin. Dette tillater mer dopamin å forbli i synapsen og øker sannsynligheten for at den vil binde seg til den postsynaptiske membranen.
Kjemisk Synaptisk Overføring
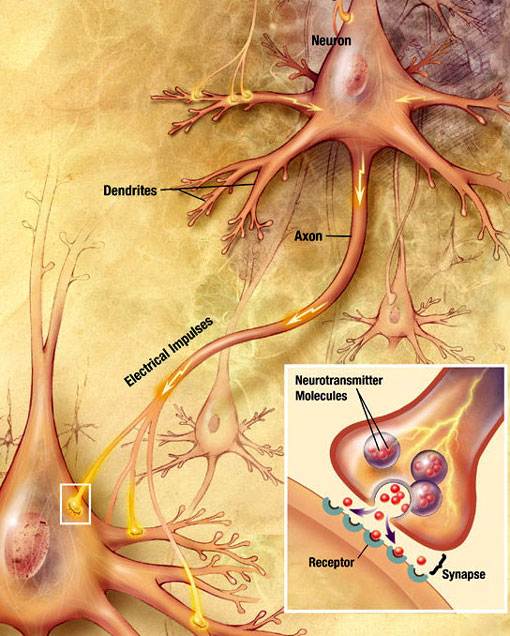
en elektrokjemisk bølge kalt et handlingspotensial reiser langs axonen til en nevron. Når handlingspotensialet når den presynaptiske terminalen, provoserer det frigjøring av en liten mengde nevrotransmittermolekyler, som binder seg til kjemiske reseptormolekyler som ligger i membranen til det postsynaptiske nevronet, på motsatt side av det synaptiske spaltet. Kilde: Wikimedia Commons.
Progressivt Tap Av Dopamin
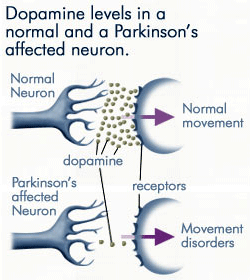
da mindre og mindre dopamin produseres av nevronene som er berørt av Parkinsons sykdom, er langt mindre dopamin tilgjengelig for å binde seg til dopaminreseptorene på den postsynaptiske membranen. Kilde: anti-agingfirewalls.com.
selv om dopamincelletap ikke kan måles direkte, viser målinger hos nevrologisk normale mennesker og hos ikke-menneskelige primater et sakte progressivt tap av dopamin med alderen. I Parkinsons sykdom oppstår tapet i mye større grad, og både biokjemiske tiltak og bildebehandlingsstudier tyder på at det er en signifikant reduksjon i dopamin når motoriske symptomer vises. I Denne visningen Er Parkinsons sykdom en akselerert versjon av celledød sett med normal aldring (Cookson, 2009). Dette er illustrert i grafen nedenfor, som viser nedgangen av dopaminerge nevroner under normal aldring, i idiopatisk PD, I pd forårsaket av miljømessige eller genetiske faktorer, og i TIDLIG debut PD.
Utvikling Av Dopaminmangel I Parkinsons Sykdom
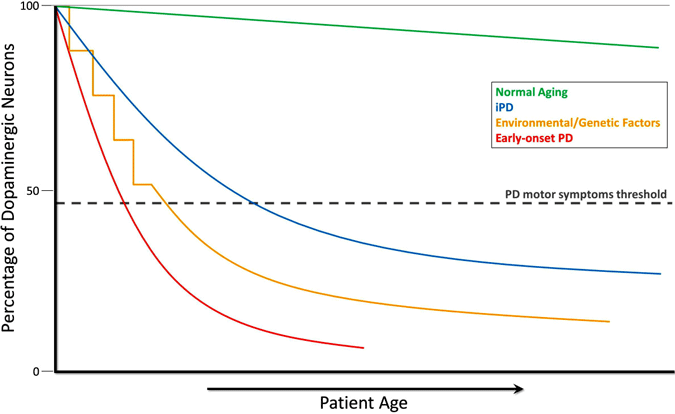
i løpet av normal aldring (grønn linje), oppstår liten, men langsom dopaminerg degenerasjon uten noen motoriske symptomer. Idiopatisk PD (ipd, blå linje) er av ukjent opprinnelse, men antas å utvikle seg gradvis, med en langsom degenerasjon av dopaminerge nevroner som fører til de klassiske pd-motoriske symptomene senere i livet. En annen modell av dopamin-neurodegenerasjon som fører TIL PD – motoriske symptomer innebærer gjentatt eksponering for miljøgifter over tid i kombinasjon med en genetisk predisponering for dopaminerg neurontap (gul linje). Tidlig oppstart AV pd (rød linje), som forårsaket av mutasjoner I PARKIN-genet, innebærer en fallende nedgang i dopaminerge nevroner, OG PD – motoriske symptomer kan presentere tiår før de i idiopatisk PD. Et annet scenario (ikke vist) av PD-motorisk symptomutvikling innebærer mulige miljøgifter eller genetiske faktorer som fører til et atypisk lavt antall dopaminerge nevroner ved fødselen og økt følsomhet for PD-utvikling (Haas et al., 2012).
Degenerasjon av dopaminneuroner er spesielt tydelig i en del av substantia nigra kalt pars compacta. Signifikant øker tap av dopamin i pars compacta den generelle eksitatoriske stasjonen i basalganglia,* forstyrrer frivillig motorstyring og forårsaker de karakteristiske symptomene PÅ PD. Normalisering av motorisk funksjon er sett i utgangspunktet med levodopa behandling (Gasparini et al., 2013).
* hovedkomponentene i basalgangliene er striatum (caudate nucleus og putamen), globus pallidus, substantia nigra, nucleus accumbens og subthalamuskjernen.
som alvorlighetsgraden av PD øker, fører uttømming av dopamin til ytterligere endringer i basalganglia veier, inkludert endret funksjon av andre basalganglia nevrotransmittere som glutamat, GABA, og serotonin (Gasparini et al., 2013). Selv om det er relativ sårbarhet for dopaminproduserende nevroner i substantia nigra, påvirkes ikke alle dopaminceller i Parkinsons sykdom; i enkelte deler av hjernen er de dopaminproduserende nevronene relativt spart (Cookson, 2009).
Nigrostriatal Pathway
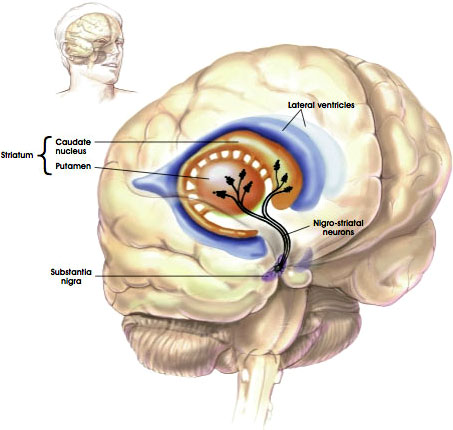
Kilde: NIH, i. d.
Lewy-Legemer Og Alfa-Synuclein
Lewy-legemer er unormale aggregater og inneslutninger av protein som utvikler seg inne i nerveceller hos Personer med Parkinsons sykdom. Aggregasjonene består vanligvis av uoppløselige fibrillære aggregater som inneholder misfoldede proteiner. Et stort antall molekyler har blitt identifisert I Lewy-legemer, men et protein kalt alfa-synuclein er hovedkomponenten.
Lewy-Legemer (Alfa-Synuclein-Inneslutninger)
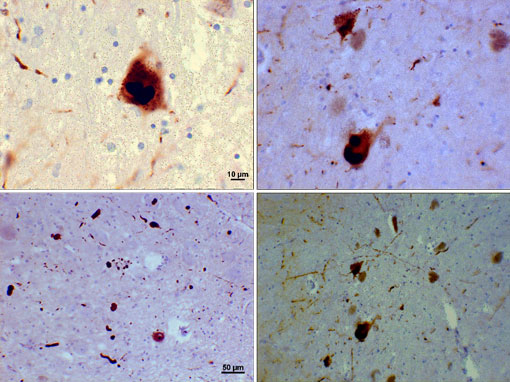
Fotomikrograf av regioner av substantia nigra i En Parkinsons pasient som viser Lewy-legemer og Lewy-neuritter i ulike forstørrelser. Topppaneler viser en 60x forstørrelse av alfa-synuclein intraneuronale inneslutninger aggregert for å danne Lewy-legemer. Bunnpanelene er 20× forstørrelsesbilder som viser strandlignende Lewy-neuritter og avrundede Lewy-legemer av forskjellige størrelser. Bilder gjengitt Av Suraj Rajan.
Lewy patologi omfatter mange regioner i hjernen og noen rapporter har antydet at substantia nigra er ikke det første stedet Hvor Lewy organer dannes I Parkinsons sykdom. Inneslutninger og aggregater symboliserer sannsynligvis sluttfasen av en kaskade av kompliserte hendelser. Et tidligere stadium kan være mer direkte knyttet til patogenesen av uorden enn inneslutninger selv, som kan eller ikke kan representere diagnostiske kjennetegn.
Lewy-legemer ses også i «demens Med Lewy-legemer», noe som tyder på at disse forholdene er relatert til hverandre ved felles patologi og muligens ved felles etiologi. Verken celletap eller Dannelse av Lewy-legemer er helt spesifikk for PD, men begge er nødvendige for en DIAGNOSE AV PD under gjeldende definisjoner (Cookson, 2009).
Nevrodegenerative lidelser som Alzheimers sykdom, frontal-temporal degenerasjon, prionsykdom, Huntingtons chorea og motoneuron sykdommer blir i økende grad realisert å ha felles cellulære og molekylære mekanismer, inkludert proteinaggregering og inklusjons kroppsdannelse i visse områder av nervesystemet (Jellinger, 2011).
Betennelse Og Immunrespons
utløseren av dopaminerg degenerasjon synes å være multifaktoriell-påvirket av både endogene og miljømessige elementer. Inflammasjon og immunresponser blir i økende grad betraktet som viktige mediatorer av dopaminerg degenerasjon. Store befolkningsstudier har antydet at personer som tar ikke-steroide antiinflammatoriske legemidler (NSAIDs), har mindre risiko for å utvikle idiopatisk PD, noe som tyder på at antiinflammatoriske legemidler kan være en lovende sykdomsmodifiserende behandling for parkinson-pasienter (Barcia, 2013).
Nye studiefaser har involvert antiinflammatoriske behandlinger-spesielt på jakt etter en objektiv biomarkør i behandlinger som tar sikte på å redusere inflammatoriske endringer hos pasienter med PD. Forskere bruker neuroimaging verktøy for å utvikle en relevant biomarkør med den hensikt å teste dette i store kliniske imaging studier. Utfallet av disse studiene vil gi data for å teste og overvåke utviklingen av antiinflammatoriske behandlinger for PD og vil bidra til å identifisere det betimelige terapeutiske vinduet for å stoppe, eller i det minste sakte, inflammatorisk mediert dopaminerg degenerasjon (Barcia, 2013).
Parkinsonisme
Parkinsonisme, også kjent som «atypisk Parkinsons», «sekundær Parkinsons» eller «Parkinsons syndrom», er et nevrologisk syndrom der en pasient viser noen av symptomene forbundet Med Parkinsons sykdom—tremor, stivhet, bradykinesi og postural ustabilitet. Men parkinsonisme er Ikke Parkinsons sykdom. Parkinsonisme antas ikke å være forårsaket Av Parkinsons sykdom, og pasienter reagerer vanligvis dårlig på farmakologisk intervensjon. Parkinsonisme har ofte en identifiserbar årsak, for eksempel eksponering for giftstoffer, metamfetamin, traumer, flere slag, andre nervesystemet lidelser, eller sykdom. Vanligvis Er Lewy-legemer ikke sett i parkinsonisme.
begrepet parkinsonisme er også forbundet med lidelser som progressiv supranukleær parese, multippel systematrofi, Lewy legeme demens, kortikobasal degenerasjon, vaskulær parkinsonisme, narkotika-indusert parkinsonisme, og parkinsonisme sekundært til infeksjon og andre årsaker (Hohler et al ., 2012). En form for reversibel parkinsonisme kan oppstå ved bruk av visse neuroleptiske legemidler, spesielt reserpin, antipsykotika (haloperidol) og metoklopramid. Eksponering for visse toksiner, alvorlig karbonmonoksydforgiftning og kvikksølvforgiftning kan også føre til parkinsonisme.
utseendet på begynnelsen av 1980-tallet av parkinsonismesymptomer hos en gruppe narkomaner som hadde konsumert en forurenset batch av et syntetisk opiat, førte til oppdagelsen av kjemisk MPTP som et middel som forårsaker parkinsonismesyndrom hos ikke-menneskelige primater så vel som hos mennesker. MPTP kan produseres når man lager en form for heroin(MPTP omdannes til et nevrotoksin som selektivt ødelegger dopaminceller i substantia nigra). Disse tilfellene er sjeldne og har hovedsakelig påvirket langsiktige narkotikabrukere.
metamfetaminmisbruk har også vært knyttet til parkinsonisme. Hos forsøksdyr skader eksponering for metamfetamin dopaminerge fibre i striatum* så vel som cellelegemene i substantia nigra, noe som gjenspeiler degenerasjonen observert hos HUMANE PASIENTER med PD. Selektiv skade på dopaminerge terminaler i striatum har også blitt observert hos humane metamfetaminbrukere, selv om det ikke er noe bevis så langt at metamfetaminmisbruk skader dopaminerge cellekropper i substantia nigra(Granado Et al ., 2013).
* den største kjernen i basalgangliene, striatum består av caudate kjernen og putamen.
det er antatt at metamfetaminbruk kan predisponere brukere for fremtidig UTVIKLING av PD. Denne hypotesen har blitt støttet av nyere epidemiologisk arbeid som indikerer at metamfetaminbrukere har økt risiko for Å utvikle PD. Dette er i samsvar med de vedvarende nevrotoksiske effektene av metamfetamin i forsøksdyr (Granado Et al., 2013).
pasienter med parkinsonisme er ofte vanskelige å håndtere som polikliniske pasienter. Kompleksiteten av deres symptomer, de ekstra kognitive og autonome underskuddene, den dårlige responsen på DE fleste PD-medisiner og den relativt raske nedgangen i status bidrar til utfordringene i å håndtere disse pasientene, særlig ettersom sykdommen utvikler seg (Hohler et al., 2012).