Bioorganic & Organisk Kjemi
Hydroboration–oksidasjon reaksjon
cis tillegg av diboran til en alken binding gir en svært nyttig metode for hydrering. Diboran kan genereres ved tilsetning av natriumborhydrid til boretrifluorideterat i tetrahydrofuran eller eter ved 0o-5oC. Diboran er dimer av boran (BH3) og er stabil form av dette reagenset (Scheme1).
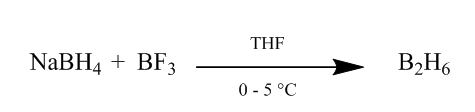
Figur 1 Hindring Av Diboran fra natriumborhydrid
tilsetningen av diboran til alken er ekstremt rask, og generelt tilføyer reagenset fra de mindre hindrede av de to ansiktene til π-systemet. Cis tillegg har blitt rasjonalisert av en fire senter overgang tilstand. Borankomplekset som følge av tilsetning av diboran til en alken omdannes, med oppbevaring av stereokjemi, til en alkohol ved behandling med basisk hydrogenperoksid. Således fører 1-metylcykloheksen1 på hydroborering-oksidasjon dannelsen av trans-2-metylcyklo-heksanol 2. Den mekanistiske banen er avbildet i (Skjema 2). Metoden for omdannelse av alken til alkohol ved hydroborering-oksidasjon har blitt anvendt for syntese av mange naturlige produkter. Få eksempler er illustrert nedenfor.

Figur 2 Reaksjonsmekanisme for dannelsen til trans-2-metylsyklo-heksanol 2
Syntese av ( ± ) junenol og ( ± ) acalomon
Bruk av hydroboration-oksidasjonsreaksjon ble observert av Banerjee og kolleger under syntesen3 av eudesmone sesquiterpener (±) junenol og (±) acalomon. For å oppnå syntesen av disse sesquiterpenene ble alken 3 valgt som utgangsmateriale og utsatt for hydroborering-oksidasjon for å gi alkoholen 4 (Skjema 3). Keton 5, oppnådd ved oksidasjon av alkoholen Med Jones reagens4 ble laget for å reagere med dietylkarbonat. Det resulterende produktet ble behandlet med metyllitium for å oppnå ketol 6 hvis konvertering til isopropylketon 7 ble utført ved henholdsvis dehydrering og hydrogenering. Metallhydrid reduksjon av keton etterfulgt av oksidasjon med bly tetraacetat5 i cykloheksan gis syklisk eter 8, som ble omdannet til ketoacid 9 ved oksidasjon med kromsyre og eddiksyre. Dekarboksylering med blytetraacetat i benzen og pyridin etterfulgt av rensing over 10% AgNO3 impregnert silikagel gitt ( ± ) akolamon 10. Reduksjon av akolamon 10 med natriumborhydrid i metanol, etterfulgt av sublimering av det resulterende produktet ga junenol 11.
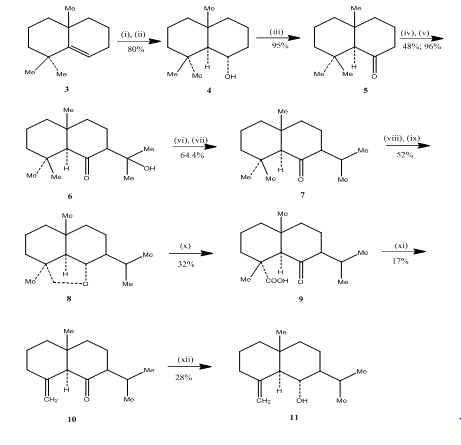
Figur 3 Syntese av eudesmone sesquiterpener (±) junenol og (±)-acalomon
Reagenser: (i) BF3.Et2o, NaBH4, Thf, 0-5°C; (ii) NaOH (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) NAH, CO(OEt)2, DME; (v) MeLi, Et2O, reflux, 2h; (vi) HCl(Konc), meoh; (vii) h2, pto2, meoh; (viii) Na, EtOH, refluks; (ix) Pb (OAc)4, C6H12; (X) CrO3, AcOH; (xi) Pb (OAc)4, C6H6, Py, refluks; (xii) NaBH4, EtOH.
Syntese av pisifersyre
bruk av hydroboreringsoksidasjon er registrert under syntesen av pisifersyre, 6 a trisykliske diterpen som viser antibakteriell aktivitet mot alle gram-positive bakterier som er testet.7 den syntetiske ruten er avbildet i Skjema 4. Hydroboration-oksidasjon av alken 13, fremstilt fra den kjente8 ketoalkohol 12, ble oksidert med jones-reagens4 og redusert henholdsvis med metallhydrid for å gi alkohol 14. Oksidasjon med bly tetraacetat i benzen MED 250w wolfram lampe ga den sykliske eter 15. Spaltningen av den sykliske eteren med sink, sinkjodid og eddiksyre8 møblert pisiferol 16. Transformasjonen av pisiferol til ester 17 ble oppnådd i seks trinn:
- Metylering med dimetylsulfat
- Oksidasjon med jones-reagens
- Forestring med diazometan
- Reduksjon med natriumborhydrid
- Tosylering
- Detosylering
ester l7 ble omdannet til pisifersyre 18 ved oppvarming med aluminiumbromid og etantiol.
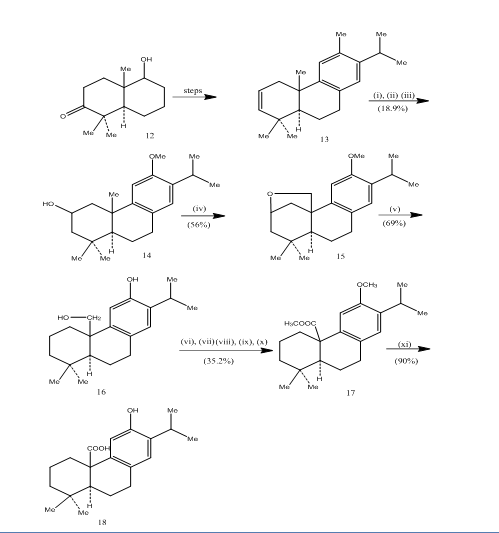
Figur 4 Syntese av pisifersyre 18
Reagenser: (i) BF3. Et2o, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv) Pb (OAc)4, CaCO3, C6H6, 250w wolframlampe; (v) Zn, ZnI, MeCOOH; (vi) MeSO4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; (ix) NaBH4, MeOH; (x) TsCl, Py; (xi) NaI, zn støv, DMF; (xii)AlBr3, (CH2SH) 2.
hydroborerings-oksidasjonsreaksjonen har blitt brukt for syntese av ( ± ) eudes-4(14),7(11)-dien-8-en, 9 taxodion, 10 norditerpene alkoholer11 og mange andre terpener.12 disse eksemplene viser tydelig bruken av bor tifluorideterat i omdannelsen av alkenene til alkoholer og deretter deres transformasjoner til terpenoidforbindelsene.
Spaltning av epoksider
epoksidene kan spaltes av flere reagenser. Lewis-syreborontrifluorideteret har også blitt brukt til spaltning av epoksider, og i mange tilfeller omarrangerer det resulterende produktet til keton. Spaltningen av epoksider er også ledsaget av syklisering. I denne gjennomgangen er spaltningen av noen epoksider med boretrifluorideterat og bruken av de resulterende produktene i syntesen av naturlige produkter blitt diskutert.
Syntese av 6-metoksy-2-tetralon
spaltningen av epoksid med boretrifluorideterat har blitt utnyttet13 for syntese av 6-metoksy-2-tetralon 20 (Skjema 5), et viktig valgt utgangsmateriale for syntese av mange organiske forbindelser. Epoksydasjon av alkene13 19 etterfulgt av behandling av råproduktet i diklormetan med boretrifluorideterat ga tetralon 20 i 36% utbytte. Når spaltningen ble forsøkt med svovelsyre, ble utbyttet av teralon 20 forbedret (39%) sammen med dannelsen av andre sekundære produkter, og dermed var kromatografisk rensing svært arbeidskrevende.
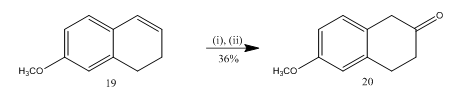
Figur 5 Syntese av 6-metoksy-2-tetralon 20
Reagenser: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
syntese av cuprane
omleggingen av epoksider av boretrifluorideterat viste seg å være svært nyttig under syntesen14 av sesquiterpene cuprane. Den syntetiske ruten er beskrevet i Skjema 6. 6,6-dimetyl-1-p-tolylcykloheksen 21 på epoksydasjon ga epoksidet 22 i godt utbytte som ved behandling med boretrifluorideterat i benzen ga aldehydet 23 i lavt utbytte. Semikarbazonet av aldehydet ble oppvarmet med kaliumhydroksyd for å gi sesquiterpen cuprane 24 i akseptabelt utbytte. Syntesen er attraktiv på grunn av sin korthet i trinn. Betingelsene som brukes for omorganisering av epoxide 22 er kritiske fordi det har en tendens til å gjennomgå ytterligere omorganisering til keton 25.
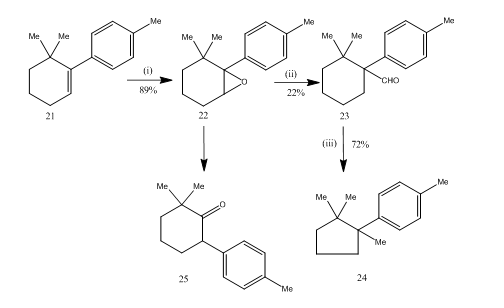
Figur 6 Syntese av cuprane
Reagenser: (I) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
Syntese av ( ± ) karahana eter
bortrifluorideterat ble også brukt til spaltning av epoksid under syntesen15 av karahana eter, en flyktig monoterpen som ble isolert16 Fra Japansk humle. Den syntetiske ruten er beskrevet i Skjema 7. Epoksidet 27, oppnådd fra dien 26, ved behandling med boretrifluorideterat gjennomgikk syklisering som ga produktet 28. Sykliseringen skjedde sannsynligvis gjennom mellomproduktet 27 (i). Metallhydrid reduksjon ga diol som på tosylering ga karahanaether 29. Utbyttet er uspesifisert. Spaltningen av epoksider har blitt brukt til syntese av mange terpener som rosenolakton, 17 cyperolon, 18 maritimol.19
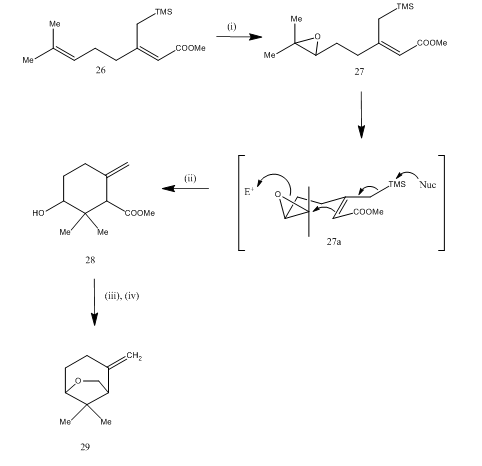
Figur 7 Syntese av ( ± ) Karahana eter
Reagenser: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
Forestring
Forestring er en hyppig brukt reaksjon for syntesen av mange organiske forbindelser. Boretrifluorideterat-alkohol er et meget praktisk reagens for forestring av mange p-amino benzoesyrer, aromatiske, heterocykliske og umettede syrer.20 i noen forestringsreaksjoner ga bruken av dette reagenset overlegen utbytte sammenlignet med andre reagenser. Noen eksempler er gitt i Skjema 8. Syrene 30-32 ble omdannet til henholdsvis esterne 33-35 i høyt utbytte ved behandling med boretrifluorideterat-alkoholreagens. Marshall og samarbeidspartnere 21 brukte samme reagens for forestring av karboksylsyrer. Dymicky22 utarbeidet flere formater i høyt utbytte fra maursyre og alkohol i nærvær av en katalytisk mengde bortrifluorid-metanolkompleks. Svovelsyre, p-toluen sulfonsyre var ikke så effektiv som bor trifluorid-metanolkompleks.
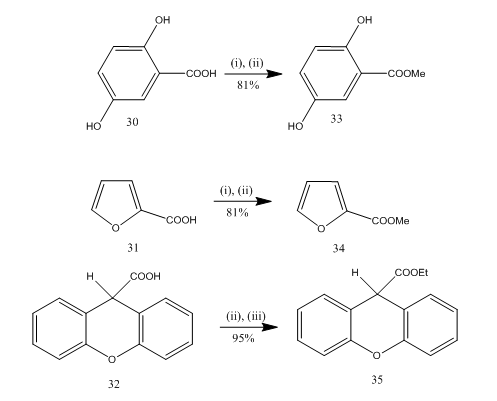
Figur 8 Forestring av syrer 32-35
Reagenser: (i) MeOH; (ii) BF3. Et2O; (iii) EtOH
Jackson og samarbeidspartnere 23 har utviklet en effektiv metode for konvertering av alkoholer 37-39 og syrer 40-42 direkte til de tilsvarende t-butylderivater i godt utbytte ved bruk av t-butyltrikloracetimidat 36 i nærvær av en katalytisk mengde boretrifluorideterat som vist i Skjema 9. Denne metoden fungerer bedre med de syrefølsomme gruppene enn de tradisjonelle metodene ved bruk av isobuten. Mindre hindret hydroksylgruppe av en diol kan beskyttes og er også egnet til småskala arbeid (unngår levering av gassformig isobuten). T-butyl 2,2,2-trikloracetimidat 36 fremstilles lett ved tilsetning av t-butanol til trikloracetonitril. De fleste forsøkene ble utført i nærvær av en blanding av diklormetan og cykloheksan. Eddiksyreanhydrid i nærvær av boretrifluorideterat har blitt benyttet for acetylering av hydroksylgruppe.24

Figur 9 Konvertering av alkoholer og syrer fra t-butylderivater.
Reagenser: 36, (i) BF3.Et2O, (ii) CH2Cl2, C6H12
Cyclization
boretrifluorideteret har spilt en viktig rolle i cyclization av mange, karboksylsyrer, allener etc. Følgende få eksempler vil illustrere rollen som boretrifluorideterat som syklusmiddel. Syre klorid 49 og alken 50 ble kondensert for å gi divinyl ketone25 51 som gjennomgikk Nazarov cyclization26, 27 møblering syklisk keton 52 som ble omdannet til sesquiterpene trichodiene 53 (Skjema 10).
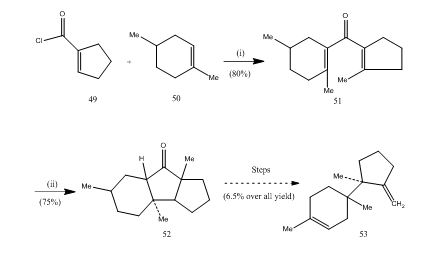
Figur 10 Syntese av sesquiterpene trichodiene 53
Reagenser: (i) SnCl4, NaOMe; (ii) BF3Et2O
Flere allenyl aryl ketoner gjennomgå syklization med bor trifluorid eter affording metylen benzocyclopentenone via en ny 5-endo-modus syklization.28 ketonene 54-56 ga henholdsvis benzocyklopentenoner 57-59 (Skjema 11). Sannsynligvis skjedde transformasjonen som vist i sykliseringen av allenyl arylketon 54 til 57. Det kan observeres at tilstedeværelsen av substituentgrupper i aromatisk ring bestemmer utbyttet av det sykliske produktet. Kos Og Loewenthal28 rapporterte sykliseringen av syren 60 med boretrifluorideterat til keton 61 som ble omdannet gibberon 62 (Skjema 12) i tre trinn:
- Ketalisering
- Huang-Minlon reduksjon og
- Syrehydrolyse. De ovennevnte eksemplene viser bruken av boretrifluorideterat i sykliseringen av organiske forbindelser
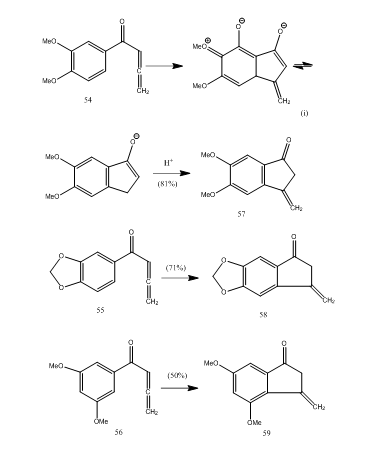
Figur 11 Syntese Av Cyklopentenoner

Figur 12 Syntese til gibberone
Reagenser: (i) BF3. Et2O; (ii) (A) C2H6O2; (B) DEG, N2H4, KOH, 190-200°C; (c) H+