Kaliumkromat
Kaliumkromat Kjemiske Egenskaper, Bruksområder, Produksjon
Uorganisk forbindelse
Kaliumkromat, kjent som tarapakaitt, er en uorganisk forbindelse, som er gul orthorhombisk eller sekskantet krystall ved romtemperatur. Den relative tettheten er 2.732, og smeltepunktet er 968 °C. det er giftig Og kan oppløses i vann for å danne alkalisk kromationhydrolyseoppløsning. Og det er uløselig i alkohol og eter. Etter tilsatt syre blir den gule løsningen av kaliumkromat oransje, som er fargen på dikromat. Det er en likevekt mellom omdannelsen av kromat og dikromat i løsningen: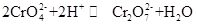
når syren blir tilsatt kaliumkromatoppløsningen, vil likevekten skifte mot retningen for å generere kaliumdikromat, og når alkalien blir tilsatt kaliumdikromatoppløsningen, vil likevekten skifte til retningen for å generere kaliumkromat. Kaliumkromat har oksidative egenskaper, og det kan reagere med reduksjonsmidlet i alkalisk medium for å danne Cr (OH)4 – (Nemlig CrO2 -). Tilsetning av forskjellige løsninger som inneholder henholdsvis bariumion, blyion og sølvion til kaliumkromatoppløsningen, vil danne det tilsvarende uoppløselige kromatet: bariumkromat BaCrO4( gul), blykromat pbCrO4(gul), sølvkromat Ag2CrO4 (Mursteinrød). Og tilstedeværelsen av kromationer kan demonstreres ved den karakteristiske fargen til disse uoppløselige kromatene. Kaliumkromat kan brukes som analytisk reagens, oksidant, mordant, metall rustinhibitor, og brukes til barium-og sølvsporanalyse. Det kan også brukes som råvarer av soling og medisinindustrien og andre kromforbindelser. Kromitt Fe (CrO2)2 pulver kan brukes som råmateriale og kalsinert med kaliumhydroksyd, kalkstein (dolomitt) i luften, og deretter ekstrahert med kaliumsulfatløsning for å oppnå kaliumkromat.
ovennevnte informasjon er redigert Av Xiao Nan Of Chemicalbook.
Kaliumkromatindikatormetode
Kaliumkromatindikatormetode, også kjent Som Moore (Mohr), er en utfellingstitreringsmetode (sølvmetode) som bruker kaliumkromat (K2CrO4) som indikator og sølvnitrat (AgNO3) som standardløsning. Denne metoden brukes hovedsakelig til bestemmelse av klorion (Cl -) eller bromidion (Br-). Legg til en liten Mengde K2CrO4 som indikator før du angir bestemmelse, og titrerer deretter Med AgNO3 standardløsning. Etter starten av titreringen faller bunnfallet av hvitt (sølvklorid) eller blekgult (sølvbromid) først ut. Når Cl – Eller Br – utfelles kvantitativt, vil et lite overskudd av sølvnitratoppløsning føre til at konsentrasjonen Av Ag + plutselig øker og umiddelbart genererer mursteinsrød sølvkromat (Ag2CrO4) utfelling, noe som indikerer titreringsendepunktet. Mengden indikator og surheten i løsningen er to store problemer med denne titreringsmetoden. Hvis k2cro4-konsentrasjonen er for høy, vil fargen på titreringsløsningen være for dyp til å hindre observasjon Av Ag2CrO4-utfellingsfarge til slutt; Hvis k2cro4-konsentrasjonen er for lav, vil det være behov for en overdreven betydelig mengde sølvnitratløsning etter kvantitativ nedbør av sølvhalogenid for å generere sølvkromatutfelling for å instruere titreringsendepunktet, noe som vil føre til at titreringsfeilen øker. Når 0,1 mol/l AgNO3-løsningen brukes til å titrere 0.1mol / l halogenid, hvis konsentrasjonen Av K2CrO4 er 5× 10-3mol/l, er sluttpunktfeilen bare +0,06%, noe som kan antas at nøyaktigheten av analyseresultatet ikke påvirkes. K2cro4 indikatormetode kan ikke utføres i sur eller alkalisk oppløsning, Fordi K2CrO4 vil bli omdannet til kaliumdikromat (K2Cr2O7) ved en liten pH-verdi, Og Ag+ vil utfelle i form av sølvoksid (Ag2O) når pH er for høy. Vanligvis er det passende surhetsområdet pH = 6,5~ 10,5, men når det er ammoniumsalter i oppløsning, er løsningens surhet pH = 6,5~7,2 passende.
kaliumkromatindikatormetoden kan bare brukes til direkte titrering Av Cl – eller Br-ioner, og titreringsresultatet er deres totale når de eksisterer samtidig. Denne metoden er ikke egnet for bestemmelse av jodidion (I- ) eller tiocyanation (SCN -), fordi de absorberes for lett ved sedimentering og sluttpunktet er uklart. Denne metoden er heller ikke egnet for titrering Av Ag+ Med Cl-, Men Ag + kan bestemmes ved hjelp av tilbake titrering, nemlig legge til en overdreven mengde nacl standardløsning i testløsningen, og bruk Deretter AgNO3 standardløsning for å titrere overskytende Cl-ioner. I løsningen kan alle kationer som kan danne utfelles Med CrO2-4 eller anioner som kan utfelle Med Ag+, forstyrre bestemmelsen. Kalium kromat indikator metoden brukes hovedsakelig for bestemmelse Av Cl-ioner i meget fortynnet løsning, slik som bestemmelse Av Cl-i drikkevann og industriprodukter urenheter.
Kaliumdikromat
Kaliumdikromat, også kjent som rødt alunkalium, er oransje-rød triclinisk krystall eller nållignende krystall. Tettheten er 2,676 g / cm3. Smeltetemperaturen er 398 °C. Det er løselig i vann og uløselig i etanol. Den har sterk oksiderende egenskap og dekomponerer ved 1300 °C.
i produksjon brukes kaliumdikromat alltid til å introdusere krom for å gjøre emaljen farget ved smelting. Det er fargestoffet av farget titan melk gul glasur og titan gul glasur, og den brukte doseringen er vanligvis 0,06%~0,12%. Kaliumdikromat og kobberoksid kan også blandes-brukes til å oppnå grønn, bambusgrønn, fruktgrønn og annen fargeglasur. Imidlertid er disse fargede glasurene generelt mindre glatte på grunn av påvirkning av kromat.
fargeglasset som er oppnådd fra kromoksid eller kalium (natrium) dikromat, er ofte gulgrønn på grunn av valensendringen av kromioner i smelteprosessen. Kaliumdikromat brukes også ofte til å lage forskjellige grønne pigmenter og rosa pigmenter.
Kaliumdikromat skal oppfylle de påkrevde målene: kaliumdikromatinnhold ≥ 99%, klorid (Cl) innhold ≤ 0.08%, vann uoppløselig ≤ 0.05%.
ovennevnte informasjon er utarbeidet Av Yaoyao Of Chemicalbook.
Oppløselighet i vann (g/100 ml)
Oppløste gram per 100 ml vann ved forskjellige temperaturer (°C):
60 g/10 °C; 63.7 g/20 °C; 66.7 g/30 °C; 67.8 g/40 °C
70.1 g/60 °C; 74.5 g/90 °C
Toksisitet
> Se sodium chromate
Kjemiske egenskaper
Sitron gul orthorhombic krystall, Løselig i vann, uløselig i alkohol
Søknad
Brukes som analytisk reagens, oksiderende, mordant og rust metall-hemmer;brukes til fremstilling av chromate,brukt som oxidant og mordant av trykking og farging. Brukes til blekk, maling, emalje,metallkorrosjon og så videre, hovedsakelig brukt til fremstilling av kjemiske reagenser og pigmenter.
Forberedelse
Nøytraliseringsmetode: Løs opp kaliumdikromat i moderluten og vannet, og tilsett deretter blandingen til reaktoren. Deretter tilsettes kaliumhydroksyd under omrøring for å utføre nøytraliseringsreaksjon. Det produserte kaliumkromatet er svakt alkalisk, og fordampes deretter for konsentrasjon, avkjøles for krystallisering, separeres og tørkes for å oppnå de ferdige kaliumkromatproduktene.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
den separerte moderluten vil bli returnert til oppløsningstrinnet for oppløsning av kaliumdikromat.
Kjemiske Egenskaper
sitrongule krystaller
Kjemiske Egenskaper
Kaliumkromat(VI) Er et gult krystallinsk fast stoff.
Bruker
Kaliumkromat (K2CrO4) er løselig i vann og brukes til å lage lyse gule blekkog malingspigmenter. Det brukes også som reagens i kjemiske laboratorier og som mordant for å «fikse» fargestoffer i fargede tekstiler.
Bruker
det brukes som et oksidasjonsmiddel.
Bruker
har en begrenset anvendelse i emaljer, etterbehandling av lær, rustbeskyttelse av metaller, erstattet av natriumsaltet; som reagens i analytisk kjemi.
Definisjon
ChEBI: et kaliumsalt bestående av kalium-og kromationer i et 2:1-forhold.
Definisjon
et salt som inneholder ionCrO42-.
Definisjon
kaliumkromat: et lyst gulkrystallinsk fast stoff, K2CrO4, oppløselig i vann og uoppløselig i alkohol; rhombic; r.d. 2.73; m. p. 968.3°C; dekomponerer uten koking. Det produseres industrielt ved steking av pulverkromittmalm med kaliumhydroksid og kalkstein og utvasking av den resulterende cinder med varmkaliumsulfatløsning. Potassiumchromate brukes i læretterbehandling, som tekstilmordant, og inenamels og pigmenter. I laboratorietden brukes som en analytiskreagent og som indikator. Likeandre krom (III) forbindelser det ergiftig ved inntak eller innånding.
Generell Beskrivelse
Kaliumkromat er et gult krystallinsk fast stoff. Kaliumkromat er løselig i vann. Den primære faren er trusselen mot miljøet. Umiddelbare skritt bør tas for å begrense spredningen til miljøet. Kaliumkromat brukes i kjemisk analyse, ved å lage pigmenter for maling og blekk, som et fungicid, og for å lage andre kromforbindelser.
Luft & Vannreaksjoner
Oppløselig i vann.
Reaktivitetsprofil
Oksidasjonsmidler,Som Kaliumkromat, kan reagere med reduksjonsmidler for å generere varme og produkter som kan være gassformige (forårsaker trykksetting av lukkede beholdere). Produktene kan selv være i stand til ytterligere reaksjoner (som forbrenning i luften). Den kjemiske reduksjonen av materialer i denne gruppen kan være rask eller eksplosiv, men krever ofte initiering (varme, gnist, katalysator, tilsetning av et løsningsmiddel). Eksplosive blandinger av uorganiske oksidasjonsmidler med reduksjonsmidler vedvarer ofte uforandret i lange perioder dersom initiering forhindres. Slike systemer er vanligvis blandinger av faste stoffer, men kan innebære en kombinasjon av fysiske tilstander. Noen uorganiske oksidasjonsmidler er salter av metaller som er oppløselige i vann; oppløsning fortynner, men opphever ikke oksidasjonskraften til slike materialer. Organiske forbindelser har generelt noe reduserende kraft og kan i prinsippet reagere med forbindelser i denne klassen. Faktisk reaktivitet varierer sterkt med identiteten til den organiske forbindelsen. Uorganiske oksidasjonsmidler kan reagere voldsomt med aktive metaller, cyanider, estere og tiocyanater.
Fare
Giftig ved inntak og innånding.
Helsefare
Innånding forårsaker lokal irritasjon av slimhinner; fortsatt neseirritasjon kan føre til perforering av neseseptum. Svelging kan forårsake voldelig gastroenteritt, sirkulasjonssvikt, svimmelhet, koma og giftig nefritt; inntak av store mengder kan være dødelig. Kontakt med øynene forårsaker alvorlig irritasjon og konjunktivitt. Gjentatt eller langvarig eksponering for støv, tåke eller løsninger kan forårsake dermatitt; kontakt med brudd i huden kan føre til at `kromsår» vises som sakte helende, hardt rimmede sår som gjør området sårbart for infeksjon.
Brannfare
Oppførsel Ved Brann: kan øke brannintensiteten ved kontakt med brennbare materialer. Kjøl beholdere og sølt materiale med rikelig med vann.
Sikkerhetsprofil
Bekreftet karsinogen med eksperimentelle tumorigeniske data. Giftved inntak, intravenøs, subkutan ogintramuskulære veier. Et eksperimentellteratogen. Andre eksperimentelle reproduktiveeffekter. Menneskelige mutasjonsdata rapportert. En kraftig oksidasjonsmiddel. Ved oppvarming tildekomposisjon avgir det giftige røyk AV K2O. Brukes som mordant for ull, i oksideringog behandling av fargestoffer på materialer. Se ogsåromforbindelser.
Potensiell Eksponering
Kaliumkromat brukes i utskrift: fotomekanisk behandling; krom-pigment produksjon; og ull konserveringsmetoder; å lage fargestoffer, pigmenter, blekk og emaljer; som et oksidasjonsmiddel; analytisk reagens; i galvanisering; eksplosiver.
Frakt
UN1479 Oksiderende fast stoff, i. o. s., Fareklasse: 5.1; Etiketter: 5.1-Oksidasjonsmiddel, Teknisk Navn Kreves. UN3288 Giftige faste stoffer, uorganiske, nos, Fareklasse: 6.1; Etiketter: 6.1-Giftige materialer, Teknisk Navn Kreves
Rensemetoder
Krystallisere det fra konduktivitetsvann (0,6 g / mL ved 20o), og tørk det mellom 135o og 170o.
Inkompatibilitet
en kraftig oksidasjonsmiddel. Voldelige reaksjoner med brennbare stoffer, organiske stoffer, pulverformige metaller; eller lett oksiderbare stoffer. Kontakt med hydroksylamin, hydrazin forårsaker eksplosjon.