MO FOR HF
Molekylorbitaler For Heterogene Diatomiske Molekyler
en enkel tilnærming til molekylorbital (MO) teori for heterogene diatomiske molekyler er å vise energinivådiagrammet. MO – energinivåene kan utarbeides ved å følge disse trinnene:
Husk at energien \(E_n\) for kvantetallet n er for et element med atom Z er omtrent
\
Vi bruker\ (Z_{eff}\) i stedet For Z for å bety at vi må endre atomnummeret for å få en effektiv atomladning for kjernen. Siden vi har å gjøre med omtrentlige verdier, kan Man bruke Z direkte. 1s orbital energinivå er -13,6 eV for hydrogenatomer, målt som ioniseringsenergien Til H.
for kvantetallet n = 1 er energinivået for 1s Av He omtrent-54 eV. Tilsvarende er 1s energinivået For F-1101 eV. 2s-og 2p-energinivåene For He er omtrent – 13.6 eV, som er simlar til 1s-orbitalet Av H.
dermed er 2s-energinivået For Li omtrent -6 eV. Men for multi-elektronatomer har p-subshell og s-subshell forskjellige energier på grunn av penetrasjon. På dette nivået kan vi ikke være presise om det, men bare tenke at 2p-orbitalene har høyere energi enn 2s-orbitalet. Vanligvis vil atomorbitaler med energinivåer som ligner hverandre overlappe for å danne molekylære orbitaler. Dermed matcher vi energinivåene til atomorbitaler, og gjør deretter liming Og anti-binding MOs av dem.
men hvis atom-orbitalenerginivået er veldig forskjellig, bruker vi atomorbitaler av det ufullstendige underskallet For Å danne MOs.
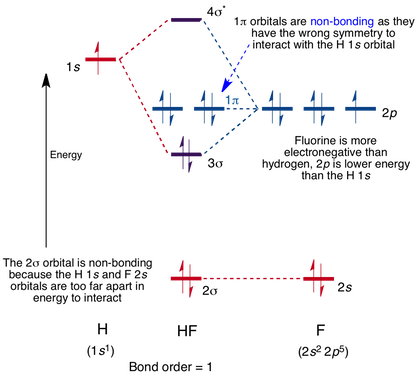
Molekylorbitaldiagram For Hf-Molekylet
Interaksjon skjer mellom 1s-orbitalet på hydrogen og 2p-orbitalet i fluor som forårsaker dannelsen av en sigma-binding Og en sigma-antibonderende molekylorbital, som vist nedenfor.