Molekylær Struktur Avslører Hvordan Antibiotika Streptomycin Virker | Bnl Newsroom
Molekylær Struktur Avslører Hvordan Antibiotika Streptomycin Virker
5. September 2013
Streptomycin Var det første antibiotikumet utviklet for å behandle tuberkulose, men inntil nylig forstod forskerne ikke helt hvordan Det fungerer på molekylært nivå. De visste at streptomycin blokkerer en kritisk prosess, syntese av proteiner ved ribosomer som fører til bakteriell celledød, men visse detaljer om samspillet forblir uoppdaget. Ved Brookhaven National Laboratory ‘ S National Synchrotron Light Source har forskere brukt røntgenkrystallografi for å fullføre bildet.
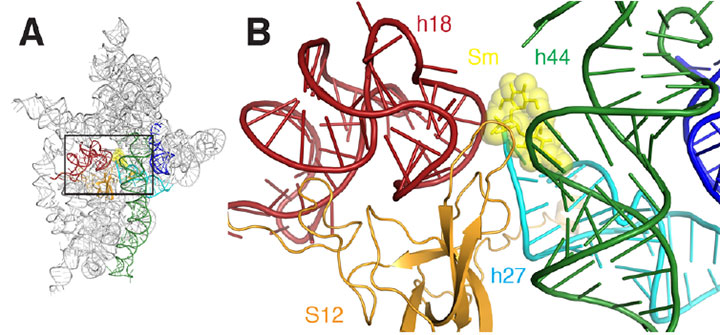
A) et bånddiagram over ribosomets bindingssted for streptomycin. B) et nærbilde av det rektangulære området skissert I A. Streptomycin er representert som gule sHcks og sfærer, helices er farget rød, mørkegrønn, cyan, oransje og blå.
Streptomycin er medlem av en familie av antibiotika som virker ved å forstyrre funksjonen av bakteriecellens ribosomer, de komplekse molekylære maskinene som lager proteiner ved å knytte aminosyrer sammen. Ribosomer, et viktig mål for antibiotika som virker ved å hemme syntesen av proteiner, har to hoveddeler eller » underenheter.»
den større underenheten gjør proteinbygningen, styrt av en TYPE rna kalt messenger RNA (mRNA), som binder seg til den. Den lille underenheten «leser» mRNA og velger det matchende transfer RNA (tRNA) molekylet, som velger og leverer neste aminosyre til ribosomet. Det er her streptomycin spiller en rolle. Det binder seg nær den lille underenhet, forårsaker det å alvorlig misread sekvensen. Dette resulterer i syntese av tilfeldige proteiner, som til slutt dreper bakteriene. Men hvordan denne feiltolkningen skjedde, forblir et mysterium, til en nylig studie av forskere Fra Brown University og Multi-institution Northeastern Collaborative Access Team Ved Argonne National Laboratory (administrert Av Cornell University).
ved å skape en krystall-en bestilt struktur av identiske enheter – av den lille ribosomale underenheten bundet til mRNA i nærvær av streptomycin, genererte forskerne flere detaljerte «øyeblikksbilder» som avslørte viktige molekylnivådetaljer om samspillet, og viste til slutt hvordan streptomycin forringer funksjonen til underenheten. PÅ NSLS beamline X25 brukte de en teknikk som kalles røntgenkrystallografi, hvor en stråle av røntgenstråler er rettet mot krystallet, interagerer med molekylene og gir et intrikat diffraksjonsmønster. Fra mønsteret, ved hjelp av dataprogramvare, konstruerte gruppen visuelle representasjoner av underenheten-mRNA-streptomycin-komplekset.
Kort sagt, forskerne kunne «se» for første gang de subtile måtene som streptomycin forvrenger strukturen på underenhetens dekodingssted, noe som førte til at den feilaktig leste mRNA. For eksempel reduserer streptomycinbinding avstanden mellom to av de mange helikser som utgjør underenhetens molekylære struktur. Dette er spesielt viktig fordi disse heliksene danner selve dekodingsstedet, og dekoding skjer bare riktig hvis disse elementene er orientert helt riktig med hensyn til mRNA og den valgte tRNA. Streptomycin binding induserer også en endring i forholdet mellom en av disse to helikser og en tredje helix, forårsaker en til å trekke seg bort fra den andre eller «løsne.»
sluttresultatet av alle disse små endringene er at streptomycin destabiliserer bindingen mellom underenheten og» riktig «tRNA samtidig som den stabiliserer bindingen av underenheten til» feil » tRNA, og dermed effektivt fjerner diskrimineringen mellom riktig og feil tRNA. Dette forårsaker ødeleggelse i bakterieforsyningskjeden for nye proteiner, forstyrrer bakteriens reproduksjon og livssyklus.
«våre strukturelle studier viste at streptomycin induserer overraskende store forvrengninger i bakteriell ribosom, noe som hjelper oss å forstå hvordan dette antibiotika forstyrrer proteinsyntese i bakterier,» sa lederforsker Gerwald Jogl, en lektor i biologi I Browns Molekylærbiologi, Cellebiologi & Biokjemi Avdeling. «Fortsetter fra våre nåværende funn, studerer vi nå hvordan mutasjoner i bakterielle ribosomer kan motvirke disse strukturelle omleggingene og gjøre det mulig for bakterier å overleve den ellers dødelige virkningen av streptomycin.»
denne undersøkelsen ble publisert i 15. januar 2013-utgaven Av Nature Communications, under tittelen » et strukturelt grunnlag for streptomycin-indusert misreading av den genetiske koden.»Støtte kom fra National Institutes Of Health og Department Of Energy.
2013-4251/INT | EXT / Newsroom