Bioorganic & Organic Chemistry
Hydroboratie-oxidatiereactie
de cis-toevoeging van diboraan aan een alkeenbinding biedt een uiterst nuttige hydratatiemethode. Diboraan kan worden gegenereerd door toevoeging van natriumborohydride aan boortrifluoride-etheraat in tetrahydrofuraan of ether bij 0o-5oC. Diboraan is het dimeer van boraan (BH3) en is stabiele vorm van dit reagens (Schema 1).
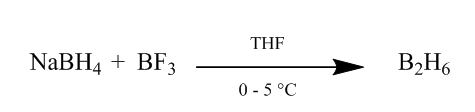
figuur 1 afname van Diboraan uit natriumborohydride
de toevoeging van diboraan aan het alkeen is extreem snel en over het algemeen voegt het reagens toe aan de minder gehinderd van de twee zijden van het π-systeem. De CIS toevoeging is gerationaliseerd door een vier centrum transitie staat. Het boraancomplex als gevolg van de toevoeging van diboraan aan een alkeen wordt, met behoud van stereochemie, omgezet in een alcohol door behandeling met basisch waterstofperoxide. Zo leidt 1-methylcyclohexeen 1 op hydroboratie-oxidatie tot de vorming van trans-2-methylcyclo-hexanol 2. Het mechanistische pad is afgebeeld in (Schema 2). De methode voor de omzetting van alkeen in alcohol door hydroboratie-oxidatie is toegepast voor de synthese van vele natuurlijke producten. Enkele voorbeelden worden hieronder geïllustreerd.

Figuur 2 reactiemechanisme voor de vorming van trans-2-methylcyclo-hexanol 2
synthese van ( ± ) junenol en ( ± ) acalomon
het gebruik van hydroboratie-oxidatiereactie werd waargenomen door Banerjee en collega ‘ s tijdens de synthese van eudsmoon sesquiterpenen ( ± ) junenol en ( ± ) acalomon. Om de synthese van deze sesquiterpenen te bereiken werd het alkeen 3 geselecteerd als uitgangsmateriaal en onderworpen aan hydroboratie-oxidatie om de alcohol 4 te produceren (schema 3). Keton 5, verkregen door de oxidatie van de alcohol met Jones-reagent4, reageert met diethylcarbonaat. Het resulterende product werd met methyllithium behandeld om ketol 6 te verkrijgen, waarvan de omzetting in isopropylketon 7 door dehydratie respectievelijk hydrogenering werd bewerkstelligd. Metaalhydride reductie van het keton gevolgd door oxidatie met loodtetraacetaat5 in cyclohexaan verkregen cyclische ether 8, die werd omgezet in ketozuur 9 door oxidatie met chroomzuur en azijnzuur. Decarboxylering met loodtetraacetaat in benzeen en pyridine, gevolgd door zuivering van meer dan 10% met AgNO3 geïmpregneerd silicagel verkregen (±) acolamon 10. Reductie van acolamone 10 met natriumborohydride in methanol, gevolgd door sublimatie van het resulterende product, leverde junenol 11 op.
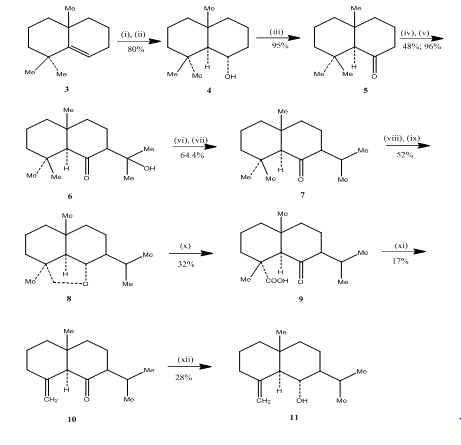
Figuur 3 synthese van eudesmone sesquiterpenen (±) junenol en (±)-acalomon
reagentia: I) BF3.Et2O, NaBH4, THF, 0-5°C; ii) NaOH (10%), H2O2 (30%); iii) CrO3/HMPT; iv) NaH, CO (OEt)2, DME; v) MeLi, Et2O, reflux, 2h; vi) HCl(conc), Meoh; VII) H2, pto2, meoh; viii) Na, EtOH, reflux; ix)Pb (OAc) 4, C6H12; x) CrO3, AcOH; xi)Pb(OAc) 4, C6H6, Py, reflux; xii) NaBH4, EtOH.
synthese van pisiferiaanzuur
het gebruik van hydroboratie-oxidatie is geregistreerd tijdens de synthese van pisiferiaanzuur (6), een tricyclisch diterpeen dat antibacteriële werking vertoont tegen alle geteste grampositieve bacteriën.7 De synthetische route is afgebeeld in Schema 4. Hydroboratie-oxidatie van alkeen 13, bereid uit het known8 ketoalcohol 12, werd geoxideerd met jones reagent4 en gereduceerd met metaalhydride tot alcohol 14. Oxidatie met loodtetraacetaat in benzeen met 250W wolfraam lamp gaf de cyclische ether 15. De splitsing van de cyclische ether met zink, zinkjodide en azijnzuur 8 geleverd pisiferol 16. De omzetting van pisiferol in ester 17 werd bereikt in zes stappen:
- methylering met dimethylsulfaat
- oxidatie met jones-reagens
- verestering met diazomethaan
- reductie met natriumboorhydride
- Tosylering
- Detosylering
ester l7 werd omgezet in pisifeerzuur 18 door verhitting met aluminiumbromide en ethaanthiol.
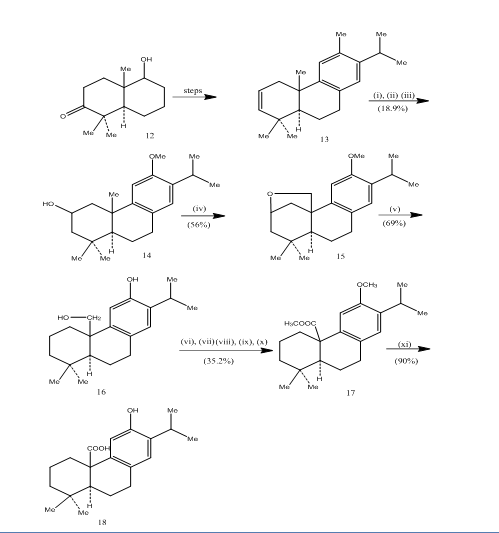
Figuur 4 synthese van pisifeerzuur 18
reagentia: I) BF3. Et2O, NaBH4; ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; iii) LiAlH4, THF; iv) Pb (OAc)4, CaCO3, C6H6, 250w wolfraamlamp; v) Zn, ZnI, MeCOOH; vi) MeSO4, Me2CO; vii) H2SO4-HCrO4; viii) CH2N2, Et2O; ix) NaBH4, MeOH; x) TsCl, Py; xi) NaI, Zn dust, DMF; xii)AlBr3, CH2SH) 2.
de hydroboratie-oxidatiereactie is toegepast voor de synthese van ( ± ) eudes-4(14),7(11)-dieen-8-one, 9 taxodion, 10 norditerpene alcohols11 en vele andere terpenen.12 Deze voorbeelden wijzen duidelijk op het gebruik van boor-tifluoride-etheraat bij de omzetting van de alkenen in alcoholen en vervolgens hun omzetting in terpenoïdenverbindingen.
splitsing van epoxiden
de epoxiden kunnen door verschillende reagentia worden gesplitst. Het Lewis-zuur borontrifluoride-etheraat is ook gebruikt voor de splitsing van epoxiden en in veel gevallen herschikt het resulterende product tot keton. De splitsing van epoxiden gaat ook gepaard met cyclisatie. In dit overzicht zijn de splitsing van sommige epoxiden met boor-trifluoride-etheraat en het gebruik van de resulterende producten in de synthese van natuurlijke producten besproken.
synthese van 6-methoxy-2-tetralon
de splitsing van epoxide met boor-trifluoride-etheraat is gebruikt13 voor de synthese van 6-methoxy-2-tetralon 20 (schema 5), een belangrijk geselecteerd uitgangsmateriaal voor de synthese van vele organische verbindingen. Epoxidatie van het alken13 19, gevolgd door behandeling van het ruwe product in dichloormethaan met boortrifluoride-etheraat, leverde tetralon een rendement op van 20 in 36%. Wanneer de splitsing werd geprobeerd met zwavelzuur werd de opbrengst van de teralon 20 verbeterd (39%) samen met de vorming van andere secundaire producten en dus was de chromatografische zuivering zeer omslachtig.
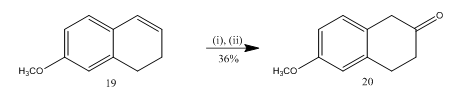
Figuur 5 Synthese van 6-methoxy-2-tetralone 20
Reagentia: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
Synthese van cuprane
De herschikking van epoxiden door boor etheraat zeer nuttig gebleken tijdens de synthesis14 van sesquiterpene cuprane. De synthetische route wordt beschreven in schema 6. 6,6-dimethyl-1-p-tolylcyclohexeen 21 bij epoxidatie leverde het epoxide 22 in goede opbrengst die bij behandeling met boor-trifluoride-etheraat in benzeen het aldehyde 23 in lage opbrengst opleverde. Het semicarbazon van het aldehyde werd verhit met kaliumhydroxide om het sesquiterpeen cuprane 24 in aanvaardbare opbrengst te leveren. De synthese is aantrekkelijk vanwege de beknoptheid in stappen. De voorwaarden die voor de herschikking van epoxide 22 worden gebruikt zijn kritiek omdat het de neiging heeft om verdere herschikking aan keton 25 te ondergaan.
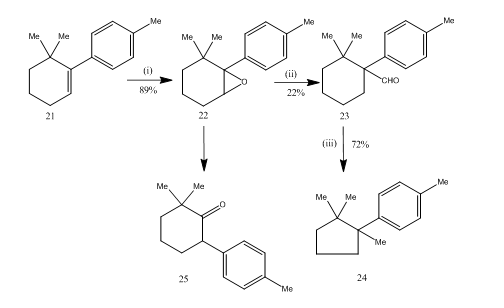
Figuur 6 Synthese van cuprane
Reagentia: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
Synthese van (±) karahana ether
Boor etheraat werd ook gebruikt voor de splitsing van epoxide tijdens de synthesis15 van karahana ether, een vluchtige monoterpene die isolated16 van Japanse hop. De synthetische route wordt beschreven in schema 7. Het epoxide 27, verkregen uit het dieen 26, na behandeling met boor-trifluoride-etheraat, werd cyclisch en leverde het product 28 op. De cyclisatie vond waarschijnlijk plaats door middel van de tussenliggende 27 (i). De reductie van metaalhydride leverde diol op, dat bij de hydratatie karahanaether opleverde 29. De opbrengst is niet gespecificeerd. De splitsing van epoxiden is gebruikt voor de synthese van vele terpenen zoals rosenolactone,17 cyperolone,18 maritimol.19
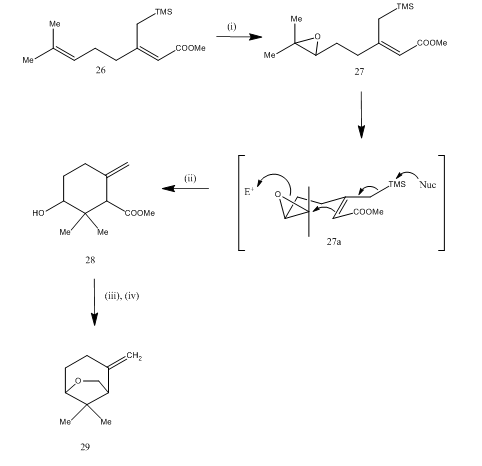
Figuur 7 synthese van ( ± ) Karahana-ether
reagentia: I) MCPBA; ii) BF3Et2O; iii) LiAlH4; iv) TsCl, Py
esterificatie
esterificatie is een veelgebruikte reactie voor de synthese van veel organische verbindingen. Boortrifluoride etheraat-alcohol is een zeer handig reagens voor de verestering van vele p-aminobenzoëzuur, aromatische, heterocyclische en onverzadigde zuren.20 in sommige esterificatiereacties leverde het gebruik van dit reagens een superieure opbrengst in vergelijking met andere reagentia. Enkele voorbeelden worden gegeven in Schema 8. De zuren 30-32 werden omgezet in de esters 33-35 respectievelijk in hoge opbrengst na behandeling met boor trifluoride etheraat-alcohol reagens. Marshall en medewerkers 21 gebruikten hetzelfde reagens voor de verestering van carbonzuren. Dymicky22 bereidde verschillende formaten met een hoge opbrengst uit mierenzuur en alcohol in aanwezigheid van een katalytische hoeveelheid boortrifluoride-methanol complex. De andere katalysatoren, zoals zwavelzuur, p-tolueensulfonzuur, waren niet zo efficiënt als boortrifluoride-methanolcomplex.
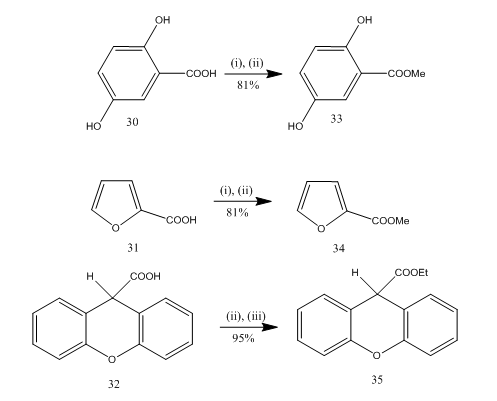
Figuur 8 verestering van zuren 32-35
reagentia: I) MeOH; ii) BF3. Et2O; iii) EtOH
Jackson en medewerkers 23 hebben een efficiënte methode ontwikkeld voor de omzetting van alcoholen 37-39 en zuren 40-42 rechtstreeks naar de overeenkomstige t-butylderivaten in goede opbrengst met behulp van t-butyl trichlooracetimidaat 36 in aanwezigheid van een katalytische hoeveelheid boor trifluoride etheraat zoals getoond in schema 9. Deze methode functioneert beter met de zure gevoelige groepen dan de traditionele methodes gebruikend isobutene. Minder belemmerde hydroxylgroep van een diol kan worden beschermd en is ook vatbaar voor kleinschalige werkzaamheden (vermijding van de overdracht van gasvormig isobuteen). Het t-butyl 2,2,2-trichlooracetimidaat 36 wordt gemakkelijk bereid door toevoeging van t-butanol aan trichlooracetonitril. De meeste experimenten werden uitgevoerd in aanwezigheid van een mengsel van dichloormethaan en cyclohexaan. Azijnzuuranhydride in aanwezigheid van boortrifluoride-etheraat is gebruikt voor acetylering van hydroxylgroep.24

figuur 9 omzetting van alcoholen en zuren uit t-butylderivaten.
reagentia: 36, (I) BF3.Et2O, (ii) CH2Cl2, C6H12
cyclisatie
het Boor-trifluoride-etheraat heeft een belangrijke rol gespeeld bij de cyclisatie van vele carbonzuren, allenen enz. De volgende voorbeelden illustreren de rol van boor-trifluoride-etheraat als cycli-agent. Het zuurchloride 49 en alkeen 50 werden gecondenseerd tot divinylketon25 51 dat Nazarov cycli onderging 26, 27 die cyclisch keton 52 dat werd omgezet in sesquiterpeen trichodien 53 (schema 10).
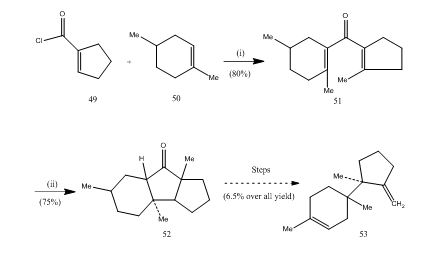
Figuur 10 synthese van sesquiterpene trichodiene 53
reagentia: (I) SnCl4, NaOMe; (ii) BF3Et2O
verscheidene allenylarylketonen ondergaan cyclisatie met boor-trifluoride-etheraat dat methyleenbenzocyclopentenon via een nieuwe 5-endo-modus cyclisatie biedt.28 de ketonen 54-56 kregen benzocyclopentenonen 57-59 respectievelijk (schema 11). Waarschijnlijk vond de transformatie plaats zoals getoond in de cyclisering van allenyl aryl keton 54 in 57. Opgemerkt kan worden dat de aanwezigheid van substituente groepen in aromatische ring de opbrengst van het cyclische product bepaalt. Kos en Loewenthal28 rapporteerden de cyclisering van het zuur 60 met boriumtrifluoride etheraat tot het keton 61 dat gibberon 62 (schema 12) in drie stappen werd omgezet:
- Ketalisatie
- huangminlon reductie en
- zure hydrolyse. De bovenstaande voorbeelden tonen het gebruik van de boor-etheraat in de cyclisatie van organische verbindingen
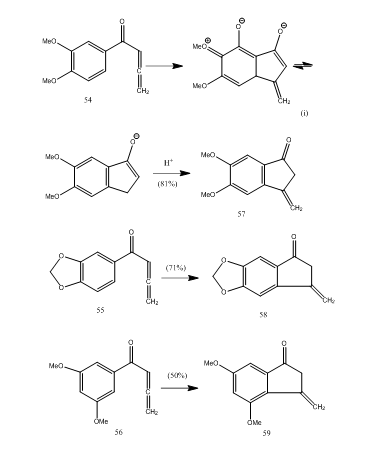
Figuur 11 Synthese van Cyclopentenones

Figuur 12 Synthese te gibberone
Reagentia: (i) BF3.Et2O; (ii) (a) C2H6O2; (b) DEG, N2H4, KOH, 190 TOT 200°C; (c) H+