elektronen In de schelpen
![]()
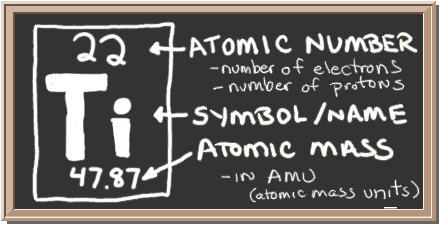
Bekijk het bord. Dat vak aan de linkerkant bevat alle informatie die je moet weten over één element. Het vertelt je de massa van een atoom, hoeveel stukken er in zitten, en waar het op het periodiek systeem moet worden geplaatst.
nu werken we met de vierde periode/rij in de tabel van elementen. Je hebt misschien een gemakkelijke manier om het aantal elektronen in een neutraal atoom te weten, maar de plaatsing van die elektronen wordt een beetje complexer. Laten we eens kijken naar de arrangementen van elektronen in de basiselementen (links en rechts van de tabel) van periode vier en de meer complexe arrangementen van de overgangs-elementen (in het midden van de rij). Als je denkt dat dit iets boven je hoofd is, ga dan terug en kijk naar de elementen 1-18 die organisaties hebben die iets eenvoudiger zijn.
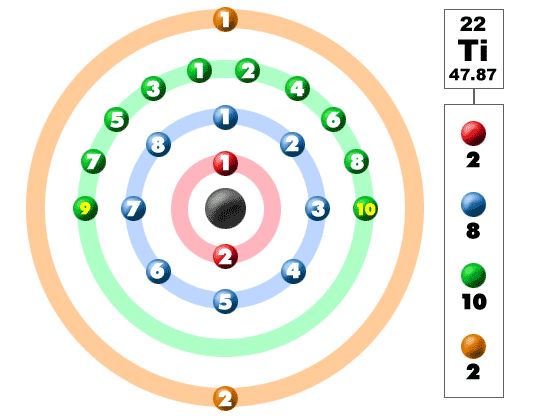
bekijk de foto hieronder. Elk van die gekleurde ballen is een elektron. In een atoom draaien de elektronen rond het centrum, ook wel de kern genoemd. De elektronen bevinden zich graag in aparte schalen/orbitalen. Als je meer leert over atomaire structuur, zul je leren dat de elektronen niet in gedefinieerde gebieden rond de kern blijven. Ze worden gevonden in wolken die verschillende vormen kunnen hebben die bollen en halter-achtige vormen omvatten. Dus vergeet niet als je kijkt naar onze afbraak dat de elektronen niet altijd in een mooie nette volgorde zoals hier getoond.
dit element is een van de overgangselementen die de extra elektronen niet in de buitenste schil plaatst, maar in de onderste. Voor de vierde periode / rij, bouwen al deze elektronen de derde schil tot een maximum van 18 elektronen. Vergeet niet dat de eerste acht werden geplaatst tijdens onze reis door de derde periode/rij. De vierde rij van het periodiek systeem heeft overgangsmetalen variërend van scandium (21) tot zink (30).
Titanium is een metaal. Het is niet zomaar metaal, het is een transitie metaal. Omdat het een overgangsmetaal is, heeft het een speciale elektronenconfiguratie. Het voegt zijn volgende elektron toe aan de derde schil, niet de buitenste vierde schil. Met een configuratie van 2-8-10-2 is titanium in de wereld en klaar om zich te binden met andere elementen. Het maakt veel natuurlijke verbindingen met halogenen en zuurstof. Aangezien titanium er is met vier extra elektronen, is het vrij flexibel en vormt vele samenstellingen.