kaliumchromaat
kaliumchromaat chemische eigenschappen, Gebruik, productie
anorganische verbinding
kaliumchromaat, algemeen bekend als tarapacaiet, is een anorganische verbinding, die geel orthorhombisch of hexagonaal kristal bij kamertemperatuur is. De relatieve dichtheid is 2.732, en het smeltpunt is 968 °C. Het is giftig en kan disolve in water om alkalische chromaat ionenhydrolyseoplossing te vormen. En het is onoplosbaar in alcohol en ether. Na toegevoegd zuur, zal de gele oplossing van kaliumchromaat oranje worden, die de kleur van dichromaat is. Er is een evenwicht tussen de omzetting van chromaat en dichromaat in de oplossing: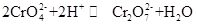
wanneer het zuur aan de kaliumchromaatoplossing wordt toegevoegd, verschuift het evenwicht naar de richting waarin kaliumchromaat wordt geproduceerd, en wanneer de alkali aan de kaliumchromaatoplossing wordt toegevoegd, verschuift het evenwicht naar de richting waarin kaliumchromaat wordt geproduceerd. Kaliumchromaat heeft oxidatieve eigenschappen, en het kan reageren met het reductiemiddel in alkalisch medium om Cr(OH)4-(namelijk CrO2 -) te vormen. Het toevoegen van verschillende oplossingen die respectievelijk bariumion, loodion en zilverion bevatten aan de kaliumchromaatoplossing vormt het overeenkomstige onoplosbare chromaat: bariumchromaat BaCrO4 (geel), loodchromaat pbCrO4(geel), zilverchromaat Ag2CrO4 (steenrood). En de aanwezigheid van chromaationen kan worden aangetoond door de karakteristieke kleur van deze onoplosbare chromaten. Kaliumchromaat kan worden gebruikt als analytisch reagens, oxidant, beitsmiddel, metaalroestinhibitor, en gebruikt voor barium-en zilveren sporenanalyse. Het kan ook als grondstoffen van het looien en de geneeskunde industrie en andere chromiumverbindingen worden gebruikt. Chromiet Fe (CrO2)2 poeder kan worden gebruikt als grondstof en gecalcineerd met kaliumhydroxide, kalksteen (dolomiet) in de lucht, en vervolgens geëxtraheerd met kaliumsulfaat oplossing om kaliumchromaat te verkrijgen.
bovenstaande informatie is bewerkt door Xiao Nan van Chemicalbook.
Kaliumchromaatindicatormethode
Kaliumchromaatindicatormethode, ook bekend als Moore (Mohr), is een precipitatietitratiemethode (zilvermethode) waarbij kaliumchromaat (K2CrO4) als indicator en zilvernitraat (AgNO3) als standaardoplossing worden gebruikt. Deze methode wordt voornamelijk gebruikt voor de bepaling van chloor-Ion (Cl -) of bromide-ion (Br -). Voeg een kleine hoeveelheid K2CrO4 als indicator toe voordat de bepaling wordt vermeld en titreer vervolgens met de AgNO3-standaardoplossing. Na het begin van de titratie precipiteert eerst het neerslag van wit (zilverchloride) of lichtgeel (zilverbromide). Wanneer Cl – of Br-kwantitatief precipiteert, zal een beetje overmaat zilvernitraatoplossing de concentratie van Ag+ plotseling doen toenemen om onmiddellijk baksteenrood zilverchromaat (Ag2CrO4) precipitatie te genereren, wat het titratie-eindpunt aangeeft. De hoeveelheid indicator en de zuurgraad van de oplossing zijn twee belangrijke problemen van deze titratiemethode. Als de k2cro4-concentratie te hoog is, zal de kleur van de titratieoplossing te diep zijn om de waarneming van de Ag2CrO4-precipitatiekleur uiteindelijk te belemmeren; als de k2cro4-concentratie te laag is, zal na de kwantitatieve precipitatie van zilverhalogenide een te grote hoeveelheid zilvernitraatoplossing nodig zijn om zilverchromaatprecipitatie te genereren om het titratie-eindpunt te instrueren, waardoor de titratiefout toeneemt. Wanneer de 0,1 mol/l AgNO3-oplossing wordt gebruikt om de 0 te titreren.1mol / l halide, als de concentratie van K2CrO4 5× 10-3mol/l is, is de eindpuntfout slechts +0,06%, waarvan kan worden aangenomen dat de nauwkeurigheid van het analyseresultaat niet wordt beïnvloed. K2cro4 indicatormethode kan niet worden uitgevoerd in zure of alkalische oplossing, omdat K2CrO4 zal worden omgezet in kaliumdichromaat (K2Cr2O7) bij een kleine pH-waarde, en Ag+ zal neerslaan in de vorm van zilveroxide (Ag2O) wanneer de pH te hoog is. Algemeen, is de geschikte zuurtegraadwaaier pH = 6.5~ 10.5, maar wanneer er ammoniumzouten in oplossing zijn, is de oplossingszuurgraad pH = 6.5~7.2 aangewezen.
de kaliumchromaatindicatormethode kan alleen worden gebruikt voor de directe titratie van Cl-of Br-ionen, en het titratieresultaat is hun totaal wanneer het gelijktijdig bestaat. Deze methode is niet geschikt voor de bepaling van jodide-ion (I -) of thiocyanaat-Ion (SCN -), omdat ze te gemakkelijk worden opgenomen door sedimentatie en het eindpunt onduidelijk is. Deze methode is ook niet geschikt voor het titreren van Ag+ met Cl-, maar Ag+ kan worden bepaald met behulp van de back titratie, namelijk een overmatige hoeveelheid NaCl-standaardoplossing in de testoplossing toevoegen en vervolgens AgNO3-standaardoplossing gebruiken om overtollige Cl-ionen te titreren. In de oplossing interfereren alle kationen die precipitaten kunnen vormen met CrO2-4 of de anionen die precipiteren met Ag+ met de bepaling. Kaliumchromaat indicator methode wordt voornamelijk gebruikt voor de bepaling van de Cl-ionen in zeer verdunde oplossing, zoals de bepaling van Cl-in drinkwater en industriële producten onzuiverheden.
kaliumdichromaat
kaliumdichromaat, ook bekend als rood alumkalium, is oranjerood triclinisch kristal of naaldachtig kristal. De dichtheid is 2,676 g / cm3. De smelttemperatuur is 398 °C. Het is oplosbaar in water en onoplosbaar in ethanol. Het heeft een sterke oxiderende eigenschap en ontleedt bij 1300 °C.
in productie wordt kaliumdichromaat altijd gebruikt om chroom in te voeren om het glazuur bij het smelten kleurig te maken. Het is de kleurstof van gekleurd titanium melkgeel glazuur en titaniumgeel glazuur en de gebruikte dosering is over het algemeen 0,06%~0,12%. Kaliumdichromaat en koperoxide kunnen ook gemengd worden-gebruikt om groen, bamboegroen, fruitgroen en andere kleurglazuur te verkrijgen. Echter, deze gekleurde glazuren zijn over het algemeen minder glanzend als gevolg van de invloed van chromaat.
het kleurglazuur dat wordt verkregen uit chroomoxide of kalium (natrium) dichromaat is vaak geelgroen als gevolg van de valentieverandering van chroomionen tijdens het smeltproces. Kaliumdichromaat wordt ook algemeen gebruikt om diverse groene pigmenten en roze pigmenten te maken.
kaliumdichromaat moet aan de vereiste doelstellingen voldoen: kaliumdichromaatgehalte ≥ 99%, chloride (Cl) gehalte ≤ 0,08%, in water onoplosbaar ≤ 0,05%.
bovenstaande informatie is samengesteld door Yaoyao van Chemicalbook.
Oplosbaarheid in water(g / 100 ml)
opgeloste gram per 100 ml water bij verschillende temperaturen (°C):
60 g/10 °C; 63.7 g/20 °C; 66.7 g/30 °C; 67.8 g/40 °C
70.1 g/60 °C; 74.5 g/90 °C
Toxiciteit
Zie sodium chromate
Chemische eigenschappen
Citroen geel orthorhombische kristal; Oplosbaar in water onoplosbaar in alcohol
Toepassing
Gebruikt als analytisch reagens, oxiderende, mordant en metaal roest-remmer;gebruikt voor de vervaardiging van chromaat,gebruikt als oxidant en mordant van bedrukken en verven. Gebruikt voor inkt, verf, emaille, metaalcorrosie enzovoort,voornamelijk gebruikt bij de vervaardiging van chemische reagentia en pigmenten.
preparaat
Neutralisatiemethode: Los kaliumdichromaat op in de moedervloeistof en water en voeg het mengsel vervolgens toe aan de reactor. Voeg vervolgens onder roeren kaliumhydroxide toe om een neutralisatiereactie uit te voeren. Het geproduceerde kaliumchromaat is zwak alkalisch en verdampt vervolgens voor concentratie, gekoeld voor kristallisatie, gescheiden en gedroogd om de afgewerkte kaliumchromaatproducten te verkrijgen.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
de gescheiden moedervloeistof wordt teruggebracht naar de oplostap voor het oplossen van kaliumdichromaat.
chemische eigenschappen
Citroengele kristallen
chemische eigenschappen
kaliumchromaat(VI) is een gele kristallijne vaste stof.
gebruikt
kaliumchromaat (K2CrO4) is oplosbaar in water en wordt gebruikt om felgele inkten en verfpigmenten te maken. Het wordt ook gebruikt als reagens in chemische laboratoria en als beitsmiddel om kleurstoffen in gekleurd textiel te”fixeren”.
gebruikt
het wordt gebruikt als oxiderende stof.
toepassingen
zijn beperkt toepasbaar in email, afwerking van leer, roestvastheid van metalen, vervangen door het natriumzout; als reagens in de Analytische Chemie.
definitie
ChEBI: een kaliumzout bestaande uit kalium-en chromaationen in een verhouding van 2:1.
definitie
een zout dat het ionCrO42-bevat.
definitie
kaliumchromaat: een heldergele kristallijne vaste stof, K2CrO4, oplosbaar in water en onoplosbaar in alcohol;R.d. 2.73; m.p. 968.3°C; ontleedt zonder te koken. Het wordt industrieel geproduceerd door gepoederdchromieterts met kaliumhydroxide en kalksteen te roosteren en de resulterende sintel met hotkaliumsulfaat-oplossing uit te voeren. Potassiumchromaat wordt gebruikt in lederafwerking, als textielbestendig middel, en inenamels en pigmenten. In het laboratorium wordt het gebruikt als analytisch reagent en als indicator. Net als andere chroom(III) verbindingen istoxisch wanneer ingenomen of ingeademd.
algemene beschrijving
kaliumchromaat is een gele kristallijne vaste stof. Kaliumchromaat is oplosbaar in water. Het primaire gevaar is de bedreiging voor het milieu. Er moeten onmiddellijk maatregelen worden genomen om de verspreiding ervan naar het milieu te beperken. Kaliumchromaat wordt gebruikt in chemische analyse, bij het maken van pigmenten voor verven en inkten, als fungicide, en om andere chroomverbindingen te maken.
lucht & Waterreacties
oplosbaar in water.
Reactiviteitsprofiel
oxiderende stoffen, zoals kaliumchromaat, kunnen reageren met reducerende stoffen om warmte en gasvormige producten te produceren (waardoor gesloten recipiënten onder druk worden gezet). De producten kunnen zelf verdere reacties veroorzaken (zoals verbranding in de lucht). De chemische reductie van materialen in deze groep kan snel of zelfs explosief zijn, maar vereist vaak initiatie (warmte, vonk, katalysator, toevoeging van een oplosmiddel). Explosieve mengsels van anorganische oxiderende stoffen met reductiemiddelen blijven vaak gedurende lange tijd onveranderd, als initiatie wordt voorkomen. Dergelijke systemen zijn typisch mengsels van vaste stoffen, maar kan elke combinatie van fysische toestanden. Sommige anorganische oxiderende middelen zijn zouten van metalen die oplosbaar zijn in water; oplossing verdunt, maar maakt de oxiderende kracht van dergelijke materialen niet teniet. Organische verbindingen hebben in het algemeen wat reducerend vermogen en kunnen in principe reageren met verbindingen in deze klasse. De werkelijke reactiviteit varieert sterk met de identiteit van de organische verbinding. Anorganische oxidatiemiddelen kunnen heftig reageren met actieve metalen, cyaniden, esters en thiocyanaten.
gevaar
Giftig bij inslikken en inademen.
gezondheidsrisico
inhalatie veroorzaakt lokale irritatie van slijmvliezen; aanhoudende neusirritatie kan resulteren in perforatie van het neustussenschot. Inname kan leiden tot gewelddadige gastro-enteritis, circulatoire collaps, vertigo, coma, en toxische nefritis; inname van overmatige hoeveelheden kan fataal zijn. Contact met de ogen Veroorzaakt ernstige irritatie en conjunctivitis. Herhaalde of langdurige blootstelling aan stof, nevel, of oplossingen kan dermatitis veroorzaken; contact met breuken in de huid kan leiden tot `chroom zweren” verschijnen als langzame genezing, hard-omrande zweren die het gebied kwetsbaar voor infectie verlaten.
brandgevaar
gedrag bij brand: kan de intensiteit van het vuur verhogen als het in contact komt met brandbare materialen. Koel containers en gemorst materiaal met veel water.
veiligheidsprofiel
bevestigd carcinogeen met experimentele tumorigene gegevens. Gif door inname, intraveneuze, subcutane en intramusculaire routes. Een experimentalteratogen. Andere experimentele reproductieve effecten. Mutatiegegevens bij de mens gerapporteerd. Een krachtige oxidator. Bij verhitting geeft het giftige dampen van K2O.gebruikt als beitsmiddel voor wol, bij het oxideren en behandelen van kleurstoffen op materialen. Zie ook chromiumverbindingen.
potentiële blootstelling
kaliumchromaat wordt gebruikt bij het drukken: fotomechanische verwerking; chroom-pigment productie; en wol conserveermiddel methoden; om kleurstoffen, pigmenten, inkten en emaille te maken; als oxiderende agent; analytisch reagens; in galvaniseren; explosieven. Un1479 Oxizing solid, N.O.s., gevarenklasse: 5.1; etiketten: 5.1-Oxidizer, technische naam vereist. UN3288 toxische vaste stoffen, anorganisch, N.O. s., gevarenklasse: 6.1; etiketten: 6.1-giftige materialen, technische naam vereist
zuiveringsmethoden
kristalliseer het uit geleidbaarheids water (0,6 g/mL bij 20o) en droog het tussen 135o en 170o.
onverenigbaarheden
een krachtige oxidator. Gewelddadige reacties met brandbare stoffen, organische stoffen, metalen in poedervorm of gemakkelijk oxideerbare stoffen. Contact met hydroxylamine, hydrazine veroorzaakt explosie.