MO voor HF
moleculaire orbitalen voor heterogene Diatomaire moleculen
een eenvoudige benadering van de moleculaire orbitale (MO) theorie voor heterogene diatomaire moleculen is het energieniveaudiagram te tonen. De mo-energieniveaus kunnen als volgt worden uitgewerkt:
bedenk dat de energie \(E_n\) voor het kwantumgetal n voor een element met atomaire Z ongeveer gelijk is aan
\
we gebruiken \(Z_{eff}\) in plaats van Z om te betekenen dat we het atoomnummer moeten wijzigen om een effectieve atoomlading voor de kern te krijgen. Aangezien we te maken hebben met geschatte waarden, kan men Z direct gebruiken. Het 1s orbitale energieniveau is -13,6 eV voor waterstofatomen, gemeten als de ionisatie-energie van H.
dus voor het kwantumgetal n = 1 is het energieniveau voor 1s van He ongeveer-54 eV. Op dezelfde manier is het 1s energieniveau voor F – 1101 eV. De 2s-en 2p-energieniveaus voor He zijn ongeveer-13,6 eV, wat gelijk is aan die van 1s-orbitaal van H.
dus is het 2S-energieniveau voor Li ongeveer -6 eV. Voor multi-elektron atomen hebben de p-subschelp en de s-subschelp echter verschillende energieën als gevolg van penetratie. Op dit niveau kunnen we er niet precies over zijn, maar we denken gewoon dat de 2P orbitalen hogere energie hebben dan de 2s orbitaal. Meestal, atomaire orbitalen met energie niveaus vergelijkbaar met elkaar overlappen om moleculaire orbitalen te vormen. Zo komen we overeen met de energieniveaus van atomaire orbitalen, en maken we er dan bonding en anti-bonding MOs van.
echter, als het niveau van de atomaire orbitale energie zeer verschillend is, gebruiken we atomaire orbitalen van de onvolledige subschelp om MOs te vormen.
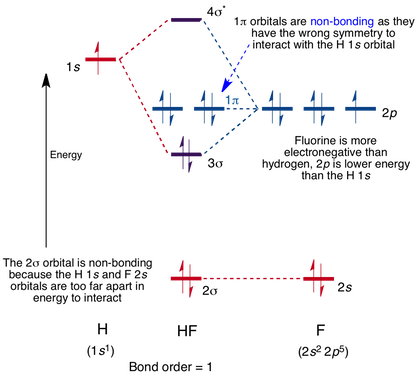
moleculair orbitaal Diagram voor het HF-molecuul
interactie vindt plaats tussen de 1s orbitaal op waterstof en de 2p orbitaal in fluor waardoor de vorming van een sigma-binding en een Sigma-antibonding moleculaire orbitaal, zoals hieronder getoond.