Moleculaire structuur onthult hoe het antibioticum streptomycine werkt / BNL Newsroom
moleculaire structuur onthult hoe het antibioticum streptomycine werkt
5 September 2013
streptomycine was het eerste antibioticum dat werd ontwikkeld om tuberculose te behandelen maar tot voor kort begrepen wetenschappers niet volledig hoe het werkt op moleculair niveau. Ze wisten dat streptomycine een kritisch proces blokkeert, de synthese van eiwitten door ribosomen die leiden tot bacteriële celdood, maar bepaalde details van de interactie bleven onontdekt. Bij de nationale Synchrotron lichtbron van het Brookhaven National Laboratory hebben onderzoekers röntgenkristallografie gebruikt om het beeld te completeren.
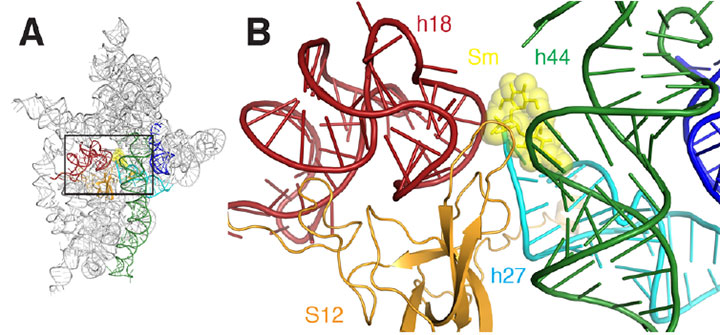
A) een lintdiagram van de streptomycine bindingsplaats van het ribosoom. B) een close-up van het rechthoekige gebied geschetst in A. streptomycine wordt weergegeven als gele sHcks en bollen, helices zijn gekleurd rood, donkergroen, cyaan, oranje, en blauw.
streptomycine behoort tot een antibioticafamilie die werkt door de functie van de ribosomen van bacteriecellen te onderbreken, de complexe moleculaire machines die eiwitten aanmaken door aminozuren aan elkaar te koppelen. Ribosomen, een belangrijk doel voor antibiotica die door de synthese van proteã nen te remmen werken, hebben twee hoofddelen of “subeenheden.”
de grotere subeenheid bouwt het eiwit, geleid door een type RNA genaamd messenger-RNA (mRNA), dat eraan bindt. De kleine subeenheid “leest” mRNA en selecteert de passende molecuul van overdrachtrna (tRNA), die het volgende aminozuur aan het ribosoom selecteert en levert. Hier speelt streptomycine een rol. Het bindt dicht aan de kleine subeenheid, veroorzakend het om de opeenvolging ernstig verkeerd te lezen. Dit resulteert in de synthese van willekeurige eiwitten, die uiteindelijk de bacteriën doodt. Maar hoe deze verkeerde interpretatie plaatsvond bleef een mysterie, tot een recente studie door onderzoekers van Brown University en het Multi-institution Northeastern Collaborative Access Team van Argonne National Laboratory (beheerd door Cornell University).
door een kristal – een geordende structuur van identieke eenheden – te creëren van de kleine ribosomale subeenheid die in aanwezigheid van streptomycine aan mRNA gebonden is, genereerden de onderzoekers verschillende gedetailleerde “snapshots” die belangrijke details op moleculair niveau van de interactie onthulden, waardoor uiteindelijk werd aangetoond hoe streptomycine de functie van de subeenheid aantast. Bij nsls beamline X25, gebruikten ze een techniek genaamd röntgenkristallografie, waarin een straal van röntgenstralen is gericht op het kristal, interageert met de moleculen, en levert een ingewikkeld diffractiepatroon. Uit het patroon, met behulp van computersoftware, construeerde de groep visuele representaties van het subunit-mRNA-streptomycine complex.
kortom, de onderzoekers konden voor het eerst de subtiele manieren” zien ” waarop streptomycine de structuur van de decodeerplaats van de subeenheid vervormt, waardoor het mRNA verkeerd kon lezen. Bijvoorbeeld, vermindert de band van streptomycine de afstand tussen twee van de vele helices die omhoog de moleculaire structuur van de subeenheid maken. Dit is bijzonder belangrijk omdat deze helices de daadwerkelijke decodeerplaats vormen, en het decoderen vindt slechts correct plaats als deze elementen precies goed met betrekking tot mRNA en geselecteerde tRNA worden georiënteerd. De band van streptomycine veroorzaakt ook een verandering in de verhouding tussen één van deze twee helices en een derde helix, veroorzakend één om zich van de andere terug te trekken of “los te maken.”
het eindresultaat van al deze kleine veranderingen is dat streptomycine de binding tussen de subeenheid en de” juiste “tRNA destabiliseert en tegelijkertijd de binding van de subeenheid aan de” verkeerde ” tRNA stabiliseert, waardoor het onderscheid tussen de juiste en de verkeerde tRNA effectief wordt weggenomen. Dit veroorzaakt ravage in de bacteriële supply chain voor nieuwe eiwitten, het verstoren van de bacteriële reproductie en de levenscyclus.”Onze structurele studies toonden aan dat streptomycine verrassend grote verstoringen in het bacteriële ribosoom veroorzaakt, wat ons helpt te begrijpen hoe dit antibioticum interfereert met de eiwitsynthese in bacteriën,” zei hoofdonderzoeker Gerwald Jogl, een universitair hoofddocent biologie in Brown ‘ s Moleculaire Biologie, Celbiologie & Biochemie Department. “Op basis van onze huidige bevindingen bestuderen we nu hoe mutaties in bacteriële ribosomen deze structurele herschikkingen kunnen tegengaan en bacteriën in staat stellen om de anders dodelijke werking van streptomycine te overleven.”
dit onderzoek werd gepubliceerd in de editie van Nature Communications van 15 januari 2013 onder de titel “a structural basis for streptomycine-induced misreading of the genetic code.”De steun kwam van de Nationale Instituten voor gezondheid en het Ministerie van energie.
2013-4251 / int / EXT / Newsroom