Nee, wetenschappers zullen nooit in staat zijn om de lege ruimte van atomen te verwijderen
als je een object in het universum zou nemen dat gemaakt is van normale materie — alles wat een mens zou kunnen aanraken, zien of anderszins een interactie met het gebruik van ons lichaam zou kunnen detecteren — dan zou je ontdekken dat je het zou kunnen opsplitsen in steeds kleinere componenten. Een heel menselijk lichaam kan worden opgesplitst in organen, die op hun beurt zijn opgebouwd uit cellen. Elke cel bestaat uit organellen, die kleinere structuren met gespecialiseerde functies zijn, en organellen zijn afhankelijk van interactie die op het moleculaire niveau voorkomen.
waaruit de volledige reeks moleculen bestaat, zijn atomen: de kleinste component van normale materie die het individuele karakter en de eigenschappen van het betrokken element behoudt. Elementen worden gedefinieerd door het aantal protonen in de kern van elk atoom, waarbij een atoom bestaat uit elektronen die rond die kern cirkelen. Maar ondanks het feit dat atomen meestal lege ruimte binnenin zijn, is er geen manier om die ruimte te verwijderen. Hier is het verhaal waarom.

een atoom, op het meest basale niveau, bestaat uit een positief geladen atoomkern die extreem klein is in volume. Voor elk proton in de atoomkern, is er een gelijke en tegenovergestelde kwantum van lading die eromheen draait, waardoor een totaal neutraal systeem ontstaat: het elektron.
maar terwijl de atoomkern beperkt is tot een uiterst klein volume — de diameter van een proton is ongeveer 1 femtometer, of 10^-15 m — nemen de elektronen, die zelf puntachtige deeltjes zijn, een volume in dat ongeveer 1 ångstrom (10^-10 m) in alle drie dimensies bedraagt.Het eerste experiment dat dit enorme verschil aantoonde is meer dan een eeuw oud, toen de natuurkundige Ernest Rutherford een dunne plaat goudfolie bombardeerde met radioactieve deeltjes.
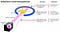
wat Rutherford deed was eenvoudig en duidelijk. Het experiment begon met een ringvormig apparaat ontworpen om deeltjes te detecteren die het vanuit elke richting tegenkomen. In het midden van de ring werd dun gehamerd goudfolie geplaatst met een dikte die zo klein was dat het niet gemeten kon worden met gereedschappen uit de vroege 20e eeuw: waarschijnlijk slechts een paar honderd of duizend atomen in doorsnede.Buiten zowel de ring als de folie werd een radioactieve bron geplaatst, zodat deze de goudfolie vanuit één bepaalde richting zou bombarderen. De verwachting was dat de uitgestoten radioactieve deeltjes de gouden folie zouden zien zoals een oplaadolifant een stuk zijdepapier zou zien: ze zouden er gewoon dwars doorheen gaan alsof de folie er helemaal niet was.
maar dit bleek alleen voor de meeste radioactieve deeltjes het geval te zijn. Een paar van hen — klein in aantal, maar van vitaal belang-gedroegen zich alsof ze stuiterde op iets hard en onbeweeglijk.

sommigen van hen verspreidden zich naar de ene of de andere kant, terwijl anderen leken terug te ketsen naar hun richting van oorsprong. Dit vroege experiment leverde het allereerste bewijs dat de binnenkant van een atoom niet een vaste structuur was zoals eerder voorzien, maar eerder bestond uit een extreem dichte, kleine kern en een veel meer diffuse buitenste structuur. Zoals Rutherford zelf opmerkte, terugkijkend decennia later,
“het was de meest ongelooflijke gebeurtenis die me ooit is overkomen in mijn leven. Het was bijna net zo ongelooflijk alsof je een 15-inch omhulsel afvuurde op een stuk papier en het kwam terug en raakte je.”
dit soort experimenten, waarbij je een laag, medium of hoog-energetisch deeltje afvuurt op een samengesteld deeltje, staat bekend als diepe inelastische verstrooiing, en het blijft onze beste methode om de interne structuur van elk systeem van deeltjes te onderzoeken.

voor het atoom, van een eenvoudige zoals waterstof tot een complexe zoals goud, lood of uranium, kunnen de elektronen worden gevonden ver buiten de omvang van de atoomkern. Terwijl een atoomkern is beperkt tot een volume dat ongeveer 1 kubieke femtometer (10^-15 meter aan elke kant), kan een elektron worden gevonden verdeeld probabilistisch over een volume dat ongeveer een biljard (101⁵) keer groter. Deze eigenschap is onafhankelijk van welk element we beschouwen, het aantal aanwezige elektronen (zolang het tenminste één is), of welke methode we gebruiken om het elektron of de kern te meten.
het feit dat atomen meestal lege ruimte zijn, is vandaag de dag zelfs bekend bij de meeste schoolkinderen, die dit feit leren op ongeveer hetzelfde moment dat ze over de structuur van atomen leren. Bij het leren van dit, velen van hen vragen zich af — en ik weet zeker dat velen van jullie zich afvragen — waarom je niet gewoon die lege ruimte en compacte atomen kan verwijderen tot veel kleinere schalen, zoals de grootte van een atoomkern?

in de klassieke wereld, waar de natuur speelt volgens regels die we kennen en die overeenkomen met wat onze intuïtie voorspelt, is het heel gemakkelijk om de posities van deeltjes te controleren. Maar op kwantumniveau is er een fundamentele beperking ingesteld door de regels van de natuur: het Heisenberg onzekerheid Principe.
zelfs als je alles weet wat er te weten valt over een elektron dat om een atoomkern draait, inclusief:
- welk energieniveau het inneemt,
- wat de kwantumtoestand is,
- en hoeveel andere elektronen er zijn in omringende energieniveaus,
er zal nog steeds een aantal eigenschappen die inherent onzeker zijn. In het bijzonder is een van de inherent onzekere eigenschappen de positie van het elektron; we kunnen alleen de kansverdeling uitrekenen van waar het elektron waarschijnlijk zal zijn.
de reden hiervoor is de inherente kwantumonzekerheid tussen positie en momentum. Het momentum van een elektron, dat we kunnen zien als de bewegingseenheid die elk deeltje zal hebben, kan met een bepaalde precisie worden gekend door het uitvoeren van een specifieke meting.
echter, hoe nauwkeuriger uw momentum-onthullende meting is, hoe groter een inherente onzekerheid de handeling van het meten zal bijdragen aan de positie van het elektron. Omgekeerd, hoe nauwkeuriger je probeert de positie van het elektron te meten, hoe groter de onzekerheid die je veroorzaakt in het elektron ‘ s momentum zal zijn. Je kunt die twee grootheden — positie en momentum — slechts met een beperkte precisie tegelijkertijd kennen, omdat het nauwkeuriger meten van één een inherent grotere onzekerheid zal creëren in de ene die je niet meet.

het elektron neemt van nature het grote volume in dat we rond de atoomkern verwachten om twee redenen.
- de grootte van de waarschijnlijkheidswolk die het elektron inneemt is afhankelijk van de lading-massaverhouding van het elektron. Met dezelfde magnitude lading als het proton maar slechts 1 / 1836e van de massa, zelfs de ultra-sterke elektromagnetische kracht kan het elektron niet beperken tot een kleiner volume dan we zien.
- de uitwendige kracht die een elektron op een atoomkern drukt en de buitenste componenten van de waarschijnlijkheidswolk beperkt, is extreem klein, zelfs voor atomen die in een ultrasterk rooster aan elkaar zijn gebonden. De krachten tussen de elektronen in twee verschillende atomen, zelfs in atomen die aan elkaar gebonden zijn, zijn zeer klein in vergelijking met de kracht tussen de atoomkern en een elektron.
elk van deze redenen geeft ons de hoop op een oplossing die in de praktijk werkt, maar met beperkte toepasbaarheid.

je kunt het elektron vervangen door een groter deeltje met dezelfde elektrische lading. Er zijn twee elektron-achtige deeltjes die in het standaardmodel bestaan met dezelfde lading als het elektron: de muon en de tau. Het muon is ongeveer 200 keer zo massief als een elektron, en dus is een atoom van muonic waterstof (met een proton voor een kern maar een muon in plaats van een elektron dat er omheen draait) ongeveer 200 keer kleiner dan standaard waterstof.
als je muonische waterstof bindt aan een aantal andere atomen, zullen ze dienen als katalysator voor kernfusie, waardoor het verder kan gaan met veel lagere temperaturen en energieën dan standaard fusie. Echter, muons leven slechts voor ~2 microseconden alvorens te vervallen, en de meer massieve Tau leeft voor minder dan een picoseconde. Deze exotische atomen zijn te vergankelijk om lang bruikbaar te blijven.

als alternatief kun je de druk op de atomen enorm verhogen door ongelooflijke hoeveelheden massa op te stapelen op één enkele plaats in de ruimte. Een individueel atoom in isolatie is misschien slechts een ångstrom in grootte, maar als je de waarde van materiaal van een ster eromheen stapelt, zal dat atoom een externe druk voelen die het elektron “knijpt” om een veel beperkter volume in te nemen.
hoe groter de druk, hoe beperkender de elektronen zijn, en hoe kleiner de atomen zijn in termen van fysische omvang. Er is een limiet aan de externe druk die de atomen kunnen weerstaan voordat dezelfde catastrofe als eerder plaatsvindt: de atoomkernen komen zo dicht bij elkaar dat hun golffuncties elkaar overlappen en kernfusie kan plaatsvinden. Bij een witte dwerg komt deze drempel voor bij ongeveer 1,4 zonsmassa ‘ s; overschrijd deze, en je zult uiteindelijk een op hol geslagen fusiereactie initiëren, wat in dit geval resulteert in een type Ia supernova.

het zou een heerlijke science fiction droom om de lege ruimte te verwijderen uit atomen, het verminderen van het volume dat materie bezet met factoren van miljoenen, biljoenen of zelfs meer. Het is echter niet zo dat de elektronen die rond de kern cirkelen inherent een extreem groot volume ruimte innemen, maar eerder dat de kwantumeigenschappen die inherent zijn aan deeltjes — massa ‘ s, ladingen, interactiesterkte en kwantumonzekerheid — allemaal samenkomen om de atomen te creëren die in ons universum bestaan.
zelfs als we een stabiele, zwaardere tegenhanger van het elektron hadden, of de mogelijkheid om materie te comprimeren tot willekeurig dichte toestanden, zouden we een kwantumdrempel tegenkomen waar de atoomkernen in het centrum van atomen spontaan zouden fuseren, waardoor stabiele configuraties van meerdere atomen helemaal niet zouden bestaan. Het feit dat onze atomen meestal lege ruimte zijn, laat het bestaan van moleculen, chemie en leven toe.Het verwijderen van de lege ruimte uit atomen is misschien een leuk gedachte-experiment, maar atomen zijn zo groot als ze zijn vanwege de regels van het universum. Ons bestaan is afhankelijk van de aanwezigheid van die lege ruimte, maar met de constanten van de natuur hebben de waarden die ze doen, maak je geen zorgen. Het kan niet anders.