16.10: Addycja Elektrofilowa: 1,2 – Versus 1,4-Addycja
reakcje addycji wyizolowanych dienów przebiegają mniej lub bardziej zgodnie z oczekiwaniami wynikającymi z zachowania prostych alkenów. Tak więc, jeśli jeden molowy odpowiednik 1,5-heksadienu jest traktowany jednym odpowiednikiem bromu, otrzymuje się mieszaninę 5,6-dibromo-1-heksenu, 1,2,5,6-tetrabromoheksanu i niezreaktywowanego dienu, przy czym związek dibromowy jest głównym produktem (około 50%)
fig
podobne reakcje sprzężonych dienów, z drugiej strony, często dają nieoczekiwane produkty. Przykładem jest dodanie bromu do 1,3-butadienu. Jak pokazano poniżej, otrzymuje się około 50: 50 mieszaninę 3,4-dibromo-1-butenu (oczekiwany produkt) i 1,4-dibromo-2-butenu (głównie izomeru E). Ten ostatni związek jest niezwykły, ponieważ pozostałe wiązanie podwójne znajduje się w miejscu, w którym nie było wiązania podwójnego w reaktanie. Ta interesująca Relokacja wymaga wyjaśnienia.
CH2=CH-CH = CH2 + Br2  |
BrCH2CHBr-CH = CH2 + | BrCH2CH=CH2Br |
| 3,4-dibromo-1-buten | 1,4-dibromo-2-buten |
oczekiwany produkt addycji z reakcji tego rodzaju jest wynikiem 1,2-addycji, czyli wiązania z sąsiednimi węglami wiązania podwójnego. Nieoczekiwany produkt pochodzi z 1,4-addycji, czyli wiązania na końcowych atomach węgla sprzężonego dienu z przesunięciem pozostałego wiązania podwójnego do położenia 2,3. (Liczby te odnoszą się do czterech węgli sprzężonego dienu i nie są numerami nomenklatorycznymi IUPAC.) Skład produktu jest często zależny od temperatury: w temperaturze 40 oC 85% mieszaniny produktu w powyższej reakcji dodawania stanowi produkt 1,4, podczas gdy w temperaturze 0 oC tylko około 30% stanowi produkt 1,4.
Wiązanie elektrofilowego atomu lub grupy z jednym z końcowych atomów węgla sprzężonego dienu (węgiel # 1 na rysunku poniżej) wytwarza pośredni kation allilowy. Takie kationy są stabilizowane przez delokalizację ładunku i to właśnie ta delokalizacja odpowiada za produkt 1,4-addycyjny wytwarzany w takich reakcjach addycyjnych. Jak pokazano na diagramie, ładunek dodatni rozkłada się na atomy węgla #2 i # 4, więc to właśnie w tych miejscach nukleofilowe wiązania składowe. Należy zauważyć, że stabilizacja rezonansowa kationu allilowego jest większa niż porównywalna stabilizacja 1,3-butadienu, ponieważ ładunek jest delokalizowany w pierwszym, ale tworzony i oddzielany w drugim.
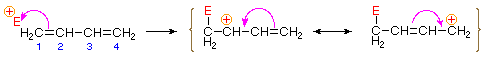
wyjaśnienie wpływu temperatury przedstawiono na poniższym schemacie energetycznym dodawania HBr do 1,3-butadienu. Początkowy etap, w którym Wiązanie protonu z węglem # 1 jest etapem determinującym szybkość, na co wskazuje duża energia aktywacji (jasnoszara strzałka). Drugi szybszy etap to etap określania produktu i istnieją dwie ścieżki reakcji (kolor niebieski dla 1,2-dodawania i magenta dla 1,4-dodawania). 1,2-addycja ma mniejszą energię aktywacji niż 1,4-addycja-zachodzi szybciej niż 1,4 addycja, ponieważ nukleofil bromowy jest bliżej węgla # 2 niż węgla #4. Jednak produkt 1,4 jest bardziej stabilny niż produkt 1,2. W niskich temperaturach produkty powstają nieodwracalnie i odzwierciedlają względne szybkości dwóch konkurujących ze sobą reakcji. Nazywa się to kontrolą kinetyczną. W wyższych temperaturach między produktami jest ustalana równowaga i dominuje preferowany termodynamicznie produkt 1,4.
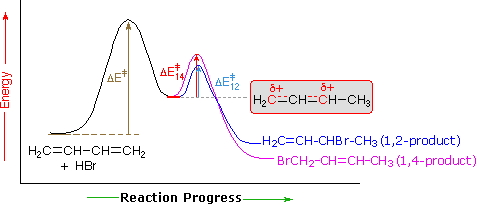
gdy sprzężony Dien jest atakowany przez elektrofil, otrzymywane produkty są mieszaniną izomerów 1,2 i 1,4. Kinetyka i Termodynamika kontrolują reakcję, gdy istnieją dwa produkty w różnych warunkach reakcji. Produkt kinetyczny (produkt A) będzie uformowany szybko, a produkt termodynamiczny (Produkt B) będzie uformowany wolniej. Zwykle pierwszy utworzony produkt jest bardziej stabilnym produktem uprzywilejowanym, ale w tym przypadku wolniejszy utworzony produkt jest bardziej stabilnym produktem; produkt B.
wprowadzenie
podobnie jak dienki sprzężone, dienki sprzężone są atakowane przez elektrofile. W rzeczywistości, sprzężone elektrofile doświadczają stosunkowo większej reaktywności kinetycznej, gdy reagują z elektrofilami niż dienów niezwiązanych. Po dodaniu elektrofilowym sprzężony Dien tworzy mieszaninę dwóch produktów-produktu kinetycznego i produktu termodynamicznego – których stosunek zależy od warunków reakcji. Reakcja dająca więcej produktu termodynamicznego jest pod kontrolą termodynamiczną, podobnie reakcja dająca więcej produktu kinetycznego jest pod kontrolą kinetyczną.
Podstawowa reakcja
Mechanizm szczegółowy
wniosek
reaktywność sprzężonych dienów (węglowodorów zawierających dwa wiązania podwójne) zmienia się w zależności od lokalizacji wiązań podwójnych i temperatury reakcji.Reakcje te mogą wytwarzać zarówno Produkty termodynamiczne, jak i kinetyczne. Izolowane wiązania podwójne zapewniają dienom mniejszą stabilność termodynamiczną niż dienom sprzężonym. Jednak są one bardziej reaktywne kinetycznie w obecności elektrofili i innych odczynników. Jest to wynikiem dodania Markownikowa do jednego z podwójnych wiązań. Karbokacja powstaje po otwarciu wiązania podwójnego. Karbokacja ta ma dwie struktury rezonansowe, a addycja może wystąpić na każdym z dodatnich atomów węgla.
problemy z praktyką
- napisz produkty 1,2 dodawania i 1,4-dodawania a) HBr i Br. B) DBr do 1,3-cykloheksadienu. Co jest niezwykłego w produktach 1,2 – i 1,4-addycji HX do niepodstawionych cyklicznych 1,3-dienów?
- czy produkt 1,2-addycyjny tworzy się szybciej w wyższych temperaturach, mimo że w tych warunkach dominuje produkt 1,4-addycyjny?
- dlaczego produkt 1,4-addycyjny jest bardziej stabilny termodynamicznie?
- z poniższych kationów radykalnych, który z nich nie jest rozsądną strukturą rezonansową?
5. Dodanie 1 odpowiednika bromu do 2,4-heksadienu w 0 stopniach C daje 4,5-dibromo-2-heksen plus izomer. Który z poniższych izomerów:
- 5,5-dibromo-2-heksen
- 2,5-dibromo-3-heksen
- 2,2-dibromo-3-heksen
- 2,3-dibromo-4-heksen
6. Który z poniższych produktów będzie kinetycznie faworyzowanym produktem przedstawionej reakcji?
7. Dodanie HBr do 2,3-dimetylo-1,3-cykloheksadienu może wystąpić w przypadku braku lub obecności nadtlenków. W każdym przypadku otrzymuje się dwa izomeryczne produkty c8h13br. Który z poniższych jest wspólnym produktem obu reakcji?
8. i 9.
8. Produktem kontrolowanym kinetycznie w powyższej reakcji jest:
- 3-Chloro-1-Buten
- 1-Chloro-2-Buten
9. Dla reakcji, o której mowa w pytaniu 8, która z nich jest wynikiem 1,4-addycji?
- 3-Chloro-1-Buten
- 1-Chloro-2-Buten
odpowiedzi na problemy
1. A) ten sam produkt dla obu trybów dodawania.
B) tworzą się zarówno izomery cis, jak i trans.
dodanie HX do niepodstawionych cykloalka-1,3-dienów w sposób 1,2-lub 1,4 daje ten sam produkt ze względu na wykorzystanie symetrii.
2. Tak. produkt kinetyczny nadal będzie tworzyć się szybciej, ale w tym przypadku będzie wystarczająco dużo energii, aby utworzyć produkt termodynamiczny, ponieważ produkt termodynamiczny jest jeszcze bardziej stabilny.
3. Produkt 1,4 jest bardziej stabilny termodynamicznie, ponieważ po każdej stronie wiązania podwójnego znajdują się dwie grupy alkilowe. Ta forma zapewnia stabilność całej konstrukcji.
4. Wszystkie te izomery są żywotne.
5. D
6. C
7. D
8. A
9. B
współpracownicy
-
William Reusch, profesor Emeritus (Michigan State U.), wirtualny Podręcznik Chemii Organicznej
-
Jim Clark (Chemguide.co.uk)
- Natasha Singh