Bioorganic & Organic Chemistry
Hydroboracja–reakcja utleniania
dodatek cis diboranu do wiązania alkenowego stanowi niezwykle użyteczną metodę hydratacji. Diboran można wytwarzać przez dodanie borowodorku sodu do eteru trifluorku boru w tetrahydrofuranie lub eterze w temperaturze 0o-5oC. Diboran jest dimerem boranu (BH3) i jest stabilną postacią tego odczynnika (Scheme1).
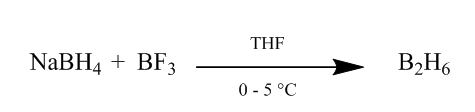
1 otrzymanie Diboranu z borowodorku sodu
dodanie diboranu do alkenu jest niezwykle szybkie i ogólnie odczynnik dodaje się z mniej utrudnionej z dwóch stron układu π. Dodatek cis został zracjonalizowany przez czterośrodkowy stan przejściowy. Kompleks boranowy powstały w wyniku dodania diboranu do alkenu przekształca się, z zachowaniem stereochemii, w alkohol przez obróbkę zasadowym nadtlenkiem wodoru. Tak więc 1-metylocykloheksen 1 na hydroborację-utlenianie prowadzi do powstania trans-2-metylocykloheksanolu 2. Mechanistyczna ścieżka została przedstawiona w (Schemat 2). Metoda konwersji alkenu do alkoholu przez hydroborację-utlenianie została zastosowana do syntezy wielu produktów naturalnych. Poniżej przedstawiono kilka przykładów.

ryc. 2 mechanizm reakcji powstawania trans-2-metylocyklo-heksanolu 2
synteza ( ± ) junenolu i ( ± ) akalomonu
wykorzystanie reakcji hydroboracji-utleniania było obserwowane przez Banerjee i współpracowników podczas syntezy3 seskwiterpenów eudesmonu ( ± ) junenolu i ( ± ) akalomonu. W celu uzyskania syntezy tych seskwiterpenów Alken 3, wybrano jako materiał wyjściowy i poddano hydroforowaniu-utlenianiu w celu uzyskania alkoholu 4 (Schemat 3). Keton 5, otrzymany przez utlenianie alkoholu za pomocą odczynnika Jonesa 4, poddano reakcji z węglanem dietylu. Otrzymany produkt poddano działaniu litu metylowego w celu uzyskania ketolu 6, którego przekształcenie do ketonu izopropylowego 7 nastąpiło odpowiednio przez odwodnienie i uwodornienie. Wodorku metali redukcja ketonu, a następnie utlenianie za pomocą tetraoctanu ołowiu 5 w cykloheksanie dało cykliczny eteru 8, który został przekształcony w kwas ketonowy 9 przez utlenianie kwasem chromowym i kwasem octowym. Dekarboksylacja tetraoctanem ołowiu w benzenie i pirydynie, a następnie oczyszczanie ponad 10% impregnowanego AgNO3 żelu krzemionkowego z dodatkiem ( ± ) acolamonu 10. Redukcja acolamonu 10 za pomocą borowodorku sodu w metanolu, a następnie sublimacja otrzymanego produktu dała junenol 11.
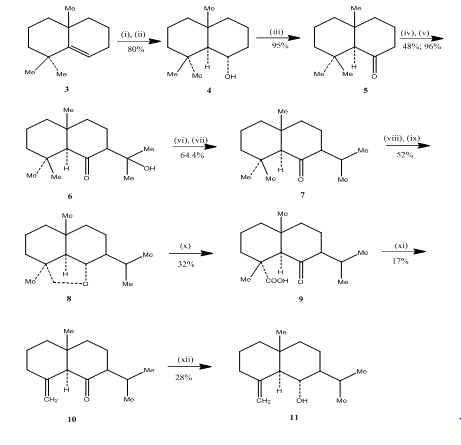
3 synteza eudesmonowych seskwiterpenów (±) junenolu i (±)-akalomonu
reagentów: (i) BF3.Et2O, NaBH4, THF, 0-5°C; (ii) NaOH (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) nah, CO(OET)2, DME; (v) Meli, Et2O, reflux, 2h; (vi) Hcl(conc), meoh; (VII) H2, pto2, meoh; viii) na, EtOH, refluks; ix) Pb (OAc)4, C6H12; X) CrO3, AcOH; xi) PB(oac)4, C6H6, Py, refluks; xii) NaBH4, EtOH.
synteza kwasu pisiferowego
podczas syntezy kwasu pisiferowego odnotowano zastosowanie hydroforowania-utleniania,6 trójpierścieniowego diterpenu, który wykazuje działanie przeciwbakteryjne wobec wszystkich badanych bakterii gram-dodatnich.7 trasa syntetyczna została przedstawiona na schemacie 4. Hydroboracja-utlenianie alkenu 13, otrzymanego ze znanego8 ketoalkoholu 12, utlenia się odczynnikiem Jonesa 4 i redukcji odpowiednio wodorkiem metalu, dając alkohol 14. Utlenianie tetraoctanem ołowiu w benzenie z lampą wolframową o mocy 250 W dało cykliczny eter 15. Rozszczepienie cyklicznego eteru cynkiem, jodkiem cynku i kwasem octowym8 spowodowało powstanie pisiferolu 16. Transformację pisiferolu do estru 17 uzyskano w sześciu etapach:
- Metylowanie siarczanem dimetylu
- utlenianie odczynnikiem Jonesa
- Estryfikacja diazometanem
- redukcja borowodorkiem sodu
- Tosylacja
- Detosylacja
ester L7 przekształcono w kwas pisiferowy 18 przez ogrzewanie bromkiem glinu i tiolem etanowym.
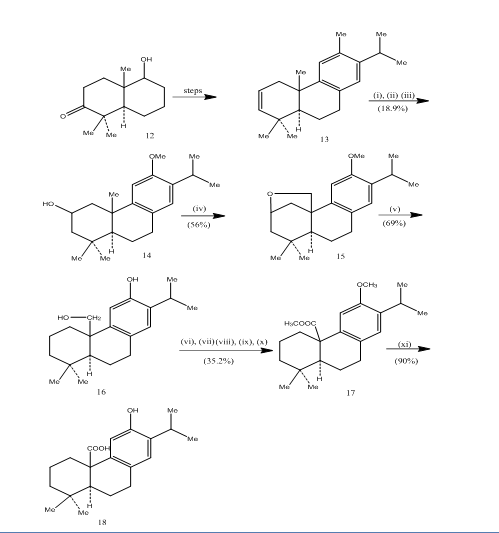
4 synteza odczynników kwasu pisiferowego 18
: (i) BF3.Et2O, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv) PB(OAC)4, CaCO3, C6H6, lampa wolframowa 250W; (v) Zn, ZnI, MeCOOH; (vi) MeSO4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; (ix) NaBH4, MeOH; (x) Tscl, Py; (xi) Nai, Zn dust, DMF; (xii)AlBr3, (CH2SH) 2.
do syntezy (±) eudes zastosowano reakcję hydroboracji-utleniania-4(14),7(11)-Dien-8-on, 9 taksodionów, 10 alkoholi norditerpenowych11 i wiele innych terpenów.12 przykłady te wyraźnie wskazują na zastosowanie tifluorku boru w przekształcaniu alkenów w alkohole, a następnie ich przekształcaniu w związki terpenoidowe.
rozszczepianie epoksydów
epoksydy można rozszczepiać za pomocą kilku odczynników. Eterynian Borontrifluorku kwasu Lewisa był również stosowany do rozszczepiania epoksydów i w wielu przypadkach otrzymany produkt przestawia się do ketonu. Rozpadowi epoksydów towarzyszy również cyklizacja. W niniejszym przeglądzie omówiono rozszczepianie niektórych epoksydów eterycznym trifluorkiem boru i wykorzystanie otrzymanych produktów w syntezie produktów naturalnych.
synteza 6-metoksy-2-tetralonu
do syntezy 6-metoksy-2-tetralonu 20 (schemat 5), ważnego wybranego materiału wyjściowego do syntezy wielu związków organicznych, wykorzystano rozszczepienie epoksydu z trifluorkiem boru. Epoksydacja alkenu1319, a następnie obróbka surowego produktu dichlorometanem eterem trifluorku boru, dawały tetralon 20 z wydajnością 36%. Gdy próbowano rozszczepiać kwasem siarkowym, wydajność teralonu 20 poprawiła się (39%) wraz z tworzeniem innych produktów wtórnych, a zatem oczyszczanie chromatograficzne było bardzo pracochłonne.
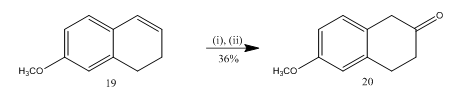
5 synteza 6-metoksy-2-tetralonu 20
odczynników: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
synteza cuprane
rearanżacja epoksydów przez eterynian trifluorku boru okazała się bardzo przydatna podczas syntezy14 cuprane seskwiterpenu. Trasa syntetyczna jest opisana w schemacie 6. 6,6-dimetylo-1-P-tolilocykloheksen 21 po epoksydacji dawał epoksyd 22 z dobrą wydajnością, który po obróbce eterykiem trifluorku boru w benzenie dał aldehyd 23 z niską wydajnością. Semikarbazon aldehydu ogrzewa się wodorotlenkiem potasu, aby dostarczyć seskwiterpenowy cuprane 24 z akceptowalną wydajnością. Synteza jest atrakcyjna ze względu na jej zwięzłość w etapach. Warunki stosowane do przegrupowania epoksydu 22 są krytyczne, ponieważ ma on tendencję do dalszego przegrupowania do ketonu 25.
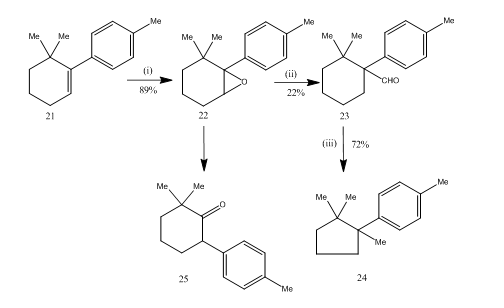
6 synteza odczynników cuprane
: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
synteza ( ± ) eteru karahana
eteru trifluorku boru została również wykorzystana do rozszczepiania epoksydu podczas syntezy15 eteru karahana, lotnego monoterpenu, który został wyizolowany z japońskiego chmielu. Trasa syntetyczna jest opisana w schemacie 7. Epoksyd 27, otrzymany z dienu 26, po obróbce eterem trifluorku boru poddano cyklizacji, otrzymując produkt 28. Cyklizacja nastąpiła prawdopodobnie przez pośredni 27 (i). Redukcję wodorków metali zapewniał diol, który po tosylacji dał karahanaeter29. Wydajność jest nieokreślona. Rozszczepienie epoksydów zostało wykorzystane do syntezy wielu terpenów, takich jak rosenolakton,17 cyperolon, 18 maritimol.19
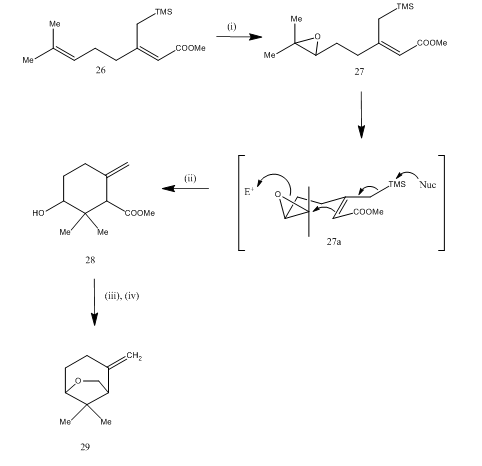
7 synteza (±) eteru Karahana
odczynników: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
Estryfikacja
Estryfikacja jest często stosowaną reakcją do syntezy wielu związków organicznych. Trifluorek boru-alkohol jest bardzo wygodnym odczynnikiem do estryfikacji wielu kwasów P-amino benzoesowych, aromatycznych, heterocyklicznych i nienasyconych.20 w niektórych reakcjach estryfikacji zastosowanie tego odczynnika zapewniało wyższą wydajność w porównaniu z innymi odczynnikami. Niektóre przykłady podano w schemacie 8. Kwasy 30-32 przekształcano odpowiednio do estrów 33-35 z wysoką wydajnością po obróbce odczynnikiem eteranianowo-alkoholowym trifluorku boru. Marshall i współpracownicy 21 używali tego samego odczynnika do estryfikacji kwasów karboksylowych. Dymicky22 przygotował kilka formatów z wysoką wydajnością z kwasu mrówkowego i alkoholu w obecności katalitycznej ilości kompleksu trifluorek boru-metanol. Inne katalizatory, np. kwas siarkowy, kwas p-toluenosulfonowy, nie były tak wydajne jak Kompleks trifluorek boru – metanol.
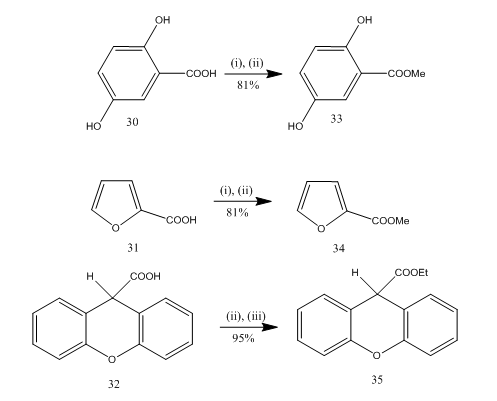
8 Estryfikacja kwasów 32-35
odczynniki: (i) MeOH; (ii) BF3. Et2O; iii) EtOH
Jackson i współpracownicy 23 opracowali skuteczną metodę konwersji alkoholi 37-39 i kwasów 40-42 bezpośrednio do odpowiednich pochodnych t-butylu z dobrą wydajnością przy użyciu trichloroacetimidatu t-butylu 36 w obecności katalitycznej ilości trifluorku boru, jak pokazano na schemacie 9. Metoda ta działa lepiej z grupami wrażliwymi na kwasy niż tradycyjne metody wykorzystujące izobuten. Mniej utrudniona grupa hydroksylowa diolu może być chroniona, a także jest podatna na prace na małą skalę (unikanie podawania gazowego izobutenu). 2,2,2-trichloroacetimidat 36 t-butylu jest łatwo wytwarzany przez dodanie t-butanolu do trichloroacetonitrylu. Większość eksperymentów przeprowadzono w obecności mieszaniny dichlorometanu i cykloheksanu. Bezwodnik octowy w obecności trifluorku boru został wykorzystany do acetylacji grupy hydroksylowej.24

9 Konwersja alkoholi i kwasów z pochodnych t-butylu.
Et2O, (ii) CH2Cl2, C6H12
Cyklizacja
eterynian trifluorku boru odegrał ważną rolę w cyklizacji wielu kwasów karboksylowych, allenów itp. Poniższe przykłady ilustrują rolę eterynianu trifluorku boru jako czynnika cyklizującego. Chlorek kwasowy 49 i Alken 50 skondensowano w wyniku czego otrzymano keton diwinylowy25 51, który poddano cyklizacji Nazarowej26, 27, a cykliczny keton 52 został przekształcony w seskwiterpenowy trichodien 53 (schemat 10).
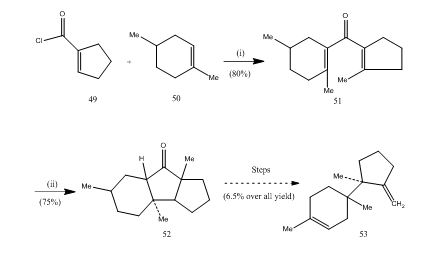
10 synteza odczynników seskwiterpenowo-trichodienowych 53
: (i) SnCl4, Naome; (ii) BF3Et2O
kilka allenylowych ketonów arylowych poddawanych jest cyklizacji z eteryczanem trifluorku boru, co daje metylenobenzocyklopentenon poprzez nową cyklizację 5-endo-modową.Ketony 54-56 dawały odpowiednio benzocyklopentenony 57-59 (schemat 11). Prawdopodobnie przemiana nastąpiła, jak pokazano w cyklizacji allenylo-aryloketonu 54 W 57. Można zaobserwować, że obecność podstawników w pierścieniu aromatycznym determinuje wydajność cyklicznego produktu. Kos i Loewenthal28 opisali cyklizację kwasu 60 Z eteryczanem trifluorku boru do ketonu 61, który został przekształcony w giberon 62 (schemat 12) w trzech etapach:
- Ketalizacja
- redukcja i
- hydroliza kwasowa. Powyższe przykłady wykazują zastosowanie eterynianu trifluorku boru w cyklizacji związków organicznych
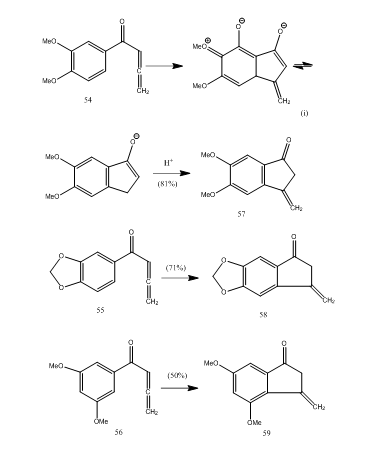
ryc. 11 synteza Cyklopentenonów

12 synteza do odczynników gibberone
: (i) BF3.Et2O; (ii) (A) C2H6O2; (b) DEG, N2H4, KOH, 190-200°C; (c) H+