chromian potasu
chromian potasu właściwości chemiczne,zastosowania,produkcja
związek nieorganiczny
chromian potasu, powszechnie znany jako tarapakaite, jest związkiem nieorganicznym, który jest żółtym, rombowym lub sześciokątnym kryształem w temperaturze pokojowej. Gęstość względna wynosi 2,732, a temperatura topnienia wynosi 968 °C. jest toksyczny i może rozpuszczać się w wodzie, tworząc roztwór hydrolizy jonów chromianu alkalicznego. I jest nierozpuszczalny w alkoholu i eterze. Po dodaniu kwasu żółty roztwór chromianu potasu zmieni kolor na pomarańczowy, który jest kolorem dichromianu. Istnieje równowaga między konwersją chromianu i dichromianu w roztworze: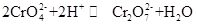
gdy kwas jest dodawany do roztworu chromianu potasu, równowaga przesunie się w kierunku wytwarzania dichromianu potasu, a gdy alkalia są dodawane do roztworu dichromianu potasu, równowaga przesunie się w kierunku wytwarzania chromianu potasu. Chromian potasu ma właściwości utleniające i może reagować ze środkiem redukującym w środowisku alkalicznym, tworząc Cr (OH) 4-(a mianowicie CrO2 -). Dodanie różnych roztworów zawierających odpowiednio jon baru, jon ołowiu i Jon srebra do roztworu chromianu potasu tworzy odpowiedni nierozpuszczalny chromian: chromian baru BaCrO4 (żółty), chromian ołowiu pbCrO4 (żółty), chromian srebra Ag2CrO4 (Czerwony ceglasty). Obecność jonów chromianowych można wykazać charakterystycznym kolorem tych nierozpuszczalnych chromianów. Chromian potasu może być stosowany jako odczynnik analityczny, utleniacz, zaprawa, inhibitor rdzy metali i stosowany do analizy śladowej baru i srebra. Może być również stosowany jako surowiec w przemyśle garbarskim i medycznym oraz innych związkach chromu. Proszek chromit Fe (CrO2) 2 może być stosowany jako surowiec i kalcynowany wodorotlenkiem potasu, wapieniem (dolomitem) w powietrzu, a następnie ekstrahowany roztworem siarczanu potasu w celu uzyskania chromianu potasu.
powyższą informację edytuje Xiao Nan z Chemicalbook.
metoda wskaźnika chromianu potasu
metoda wskaźnika chromianu potasu, znana również jako Moore (Mohr), jest metodą miareczkowania wytrącania (metoda srebra), która wykorzystuje chromian potasu (K2CrO4) jako wskaźnik i azotan srebra (AgNO3) jako roztwór standardowy. Metoda ta jest stosowana głównie do oznaczania jonu chloru (Cl -) lub jonu bromkowego (Br -). Dodać niewielką ilość K2CrO4 jako wskaźnik przed stwierdzeniem oznaczenia, a następnie miareczkować roztworem wzorcowym AgNO3. Po rozpoczęciu miareczkowania osad biały (chlorek srebra) lub bladożółty (bromek srebra) wytrąca się jako pierwszy. Gdy CL-lub Br-wytrąca się ilościowo, niewielki nadmiar roztworu azotanu srebra spowoduje nagłe zwiększenie stężenia Ag+, aby natychmiast wygenerować wytrącanie chromianu srebra (Ag2CrO4), wskazując punkt końcowy miareczkowania. Ilość wskaźnika i kwasowość roztworu to dwa główne problemy tej metody miareczkowania. Jeśli stężenie K2CrO4 jest zbyt wysokie, kolor roztworu miareczkowania będzie zbyt głęboki, aby utrudnić obserwację koloru wytrącania Ag2CrO4 w końcu; jeśli stężenie K2CrO4 jest zbyt niskie, po ilościowym wytrącaniu halogenku srebra potrzebna będzie nadmiernie znaczna ilość roztworu azotanu srebra w celu wytrącenia chromianu srebra w celu wskazania punktu końcowego miareczkowania, co spowoduje wzrost błędu miareczkowania. Gdy do miareczkowania 0 stosuje się roztwór AgNO3 o stężeniu 0,1 mol/l.1mol / l halogenek, jeśli stężenie K2CrO4 wynosi 5× 10-3mol / l, błąd punktu końcowego wynosi tylko +0,06%, co można sądzić, że dokładność wyniku analizy nie ma wpływu. Metoda wskaźnika K2CrO4 nie może być przeprowadzona w roztworze kwaśnym lub zasadowym, ponieważ K2CrO4 zostanie przekształcony w dichromian potasu (K2Cr2O7) przy małej wartości pH, a Ag+ wytrąca się w postaci tlenku srebra (Ag2O), gdy pH jest zbyt wysokie. Zwykle odpowiedni zakres kwasowości wynosi pH = 6,5~ 10,5, ale gdy w roztworze znajdują się sole amonowe, odpowiednia jest kwasowość roztworu pH = 6,5~7,2.
metoda wskaźnika chromianu potasu może być stosowana tylko do bezpośredniego miareczkowania jonów Cl-lub Br -, a wynikiem miareczkowania jest ich całkowita liczba, gdy współistnieją. Metoda ta nie jest odpowiednia do oznaczania jonów jodkowych (I-) lub tiocyjanianowych (SCN-), ponieważ są one zbyt łatwo wchłaniane przez sedymentację, a punkt końcowy jest niejasny. Metoda ta nie nadaje się również do miareczkowania Ag+ za pomocą Cl-, ale Ag+ można określić za pomocą miareczkowania wstecznego, a mianowicie dodać nadmierną ilość roztworu wzorcowego NaCl do roztworu testowego, a następnie użyć roztworu wzorcowego AgNO3 do miareczkowania nadmiaru jonów Cl. W roztworze wszystkie kationy, które mogą wytrącać się z CrO2-4 lub aniony, które mogą wytrącać się z Ag+, będą zakłócać oznaczanie. Metoda wskaźnika chromianu potasu jest stosowana głównie do oznaczania jonów Cl w bardzo rozcieńczonym roztworze, takich jak oznaczanie CL-w wodzie pitnej i produktach przemysłowych zanieczyszczeń.
dichromian potasu
dichromian potasu, znany również jako czerwony ałun potasu, jest pomarańczowo-czerwonym kryształem trójliniowym lub kryształem przypominającym igłę. Gęstość wynosi 2,676 g / cm3. Temperatura topnienia wynosi 398 °C. Jest rozpuszczalny w wodzie i nierozpuszczalny w etanolu. Ma silne właściwości utleniające i rozkłada się w temperaturze 1300 °C.
w produkcji dichromian potasu jest zawsze stosowany do wprowadzania chromu, aby szkliwo było zabarwione podczas topienia. Jest to środek barwiący kolorowej żółtej glazury tytanowej mlecznej i żółtej glazury tytanowej, a stosowana dawka wynosi zwykle 0,06%~0,12%. Dichromian potasu i tlenek miedzi można również mieszać w celu uzyskania Zielonego, bambusowego, zielonego owocu i innego koloru glazury. Jednak te kolorowe szkliwa są na ogół mniej błyszczące ze względu na wpływ chromianu.
kolor glazury otrzymanej z tlenku chromu lub dichromianu potasu (sodu) często jest żółto-zielony z powodu zmiany wartościowości jonów chromu w procesie topienia. Dichromian potasu jest również powszechnie stosowany do wytwarzania różnych zielonych pigmentów i różowych pigmentów.
dichromian potasu powinien spełniać wymagane cele: zawartość dichromianu potasu ≥ 99%, zawartość chlorku (Cl) ≤ 0,08%, nierozpuszczalny w wodzie ≤ 0,05%.
powyższą informację przygotował Yaoyao z Chemicalbook.
Rozpuszczalność w wodzie (g/100 ml)
rozpuszczone gramy na 100 ml wody w różnych temperaturach (°c):
60 g/10 °C; 63,7 g/20 °C; 66,7 g/30 °C; 67,8 g/40 °C
70,1 g/60 °C; 74,5 G/90 °C
toksyczność
Patrz chromian sodu
właściwości chemiczne
cytrynowy żółty kryształ rombowy; rozpuszczalny w wodzie; nierozpuszczalny w alkoholu
zastosowanie
stosowany jako odczynnik analityczny, utleniacz, zaprawa i inhibitor rdzy metalowej;stosowany do produkcji chromianu,stosowany jako utleniacz i zaprawa do drukowania i barwienia. Stosowany do atramentu, farby, emalii,korozji metali i tak dalej, głównie w produkcji odczynników chemicznych i pigmentów.
przygotowanie
metoda neutralizacji: Rozpuścić dichromian potasu w roztworze macierzystym i wodzie, a następnie dodać mieszaninę do reaktora. Następnie dodać wodorotlenek potasu pod mieszanie do przeprowadzenia reakcji neutralizacji. Wytworzony chromian potasu jest słabo zasadowy, a następnie odparowywany w celu zatężenia, chłodzony do krystalizacji, oddzielany i suszony w celu uzyskania gotowych produktów chromianu potasu.
K2Cr2O7 + 2koh → 2k2cro4 + H2O
oddzielony roztwór macierzysty zostanie zwrócony do etapu rozpuszczania w celu rozpuszczania dichromianu potasu.
właściwości chemiczne
cytrynowo-żółte kryształy
właściwości chemiczne
chromian potasu(VI) jest żółtym krystalicznym ciałem stałym.
używa
chromian potasu (K2CrO4) jest rozpuszczalny w wodzie i służy do wytwarzania jasnożółtych farb i pigmentów do farb. Jest również stosowany jako odczynnik w laboratoriach chemicznych i jako zaprawa do”utrwalania” barwników w kolorowych tekstyliach.
używa
jest stosowany jako środek utleniający.
zastosowania
ma ograniczone zastosowanie w emaliach, skórach wykończeniowych, antykorozyjnych metalach, zastępowanych solą sodową; jako odczynnik w chemii analitycznej.
definicja
ChEBI: sól potasowa składająca się z jonów potasu i chromianu w stosunku 2:1.
definicja
sól zawierająca joncro42-.
definicja
chromian potasu: jasnożółte krystaliczne ciało stałe, K2CrO4, rozpuszczalne w wodzie i nierozpuszczalne w alkoholu; rombowy; r.d. 2,73; m.p. 968,3°C; rozkłada się bez wrzenia. Jest wytwarzany Przemysłowo przez prażenie sproszkowanej rudy chromitu z wodorotlenkiem potasowym i wapieniem oraz wypłukiwanie powstałego żużla gorącym roztworem siarczanu potasu. Potassiumchromian jest stosowany w wykończeniu skór, jako zaprawa tekstylna oraz inenamels i pigmenty. W laboratoriachto jest używany jako analitycznyreagent i jako wskaźnik. Podobnie jak inne związki chromu(III) jest toksyczny po spożyciu lub wdychaniu.
Opis ogólny
chromian potasu jest żółtym krystalicznym ciałem stałym. Chromian potasu jest rozpuszczalny w wodzie. Podstawowym zagrożeniem jest zagrożenie dla środowiska. Należy podjąć natychmiastowe kroki w celu ograniczenia jego rozprzestrzeniania się do środowiska. Chromian potasu jest stosowany w analizie chemicznej, w produkcji pigmentów do farb i tuszów, jako środek grzybobójczy i do wytwarzania innych związków chromu.
powietrze& reakcje wody
rozpuszczalny w wodzie.
profil reaktywności
środki utleniające, takie jak chromian potasu , mogą reagować ze środkami redukującymi w celu wytworzenia ciepła i produktów, które mogą być gazowe (powodując wzrost ciśnienia w zamkniętych pojemnikach). Same produkty mogą być zdolne do dalszych reakcji (takich jak spalanie w powietrzu). Chemiczna redukcja materiałów z tej grupy może być szybka lub nawet wybuchowa, ale często wymaga inicjacji (ciepło, Iskra, katalizator, dodanie rozpuszczalnika). Wybuchowe mieszaniny nieorganicznych środków utleniających ze środkami redukującymi często utrzymują się w niezmienionej postaci przez długi czas, jeśli nie jest to możliwe. Układy takie są zazwyczaj mieszaninami ciał stałych, ale mogą obejmować dowolną kombinację stanów fizycznych. Niektóre nieorganiczne środki utleniające są sole metali, które są rozpuszczalne w wodzie; rozpuszczanie rozcieńcza, ale nie unieważnia siłę utleniającą takich materiałów. Ogólnie związki organiczne mają pewną moc redukcyjną i w zasadzie mogą reagować ze związkami z tej klasy. Rzeczywista reaktywność różni się znacznie w zależności od tożsamości związku organicznego. Nieorganiczne środki utleniające mogą reagować gwałtownie z aktywnymi metalami, cyjankami, estrami i tiocyjanianami.
Zagrożenie
Działa toksycznie przez spożycie i wdychanie.
zagrożenie dla zdrowia
wdychanie powoduje miejscowe podrażnienie błon śluzowych; ciągłe podrażnienie nosa może skutkować perforacją przegrody nosowej. Spożycie może spowodować gwałtowne zapalenie żołądka i jelit, zapaść krążeniową, zawroty głowy, śpiączkę i toksyczne zapalenie nerek; spożycie nadmiernych ilości może być śmiertelne. Kontakt z oczami powoduje silne podrażnienie i zapalenie spojówek. Wielokrotne lub długotrwałe narażenie na kurz, mgłę lub roztwory może powodować zapalenie skóry; kontakt z przerwami w skórze może powodować „owrzodzenia chromem” pojawiające się jako powolne gojenie, twarde owrzodzenia, które pozostawiają obszar podatny na infekcję.
zagrożenie pożarowe
zachowanie w pożarze: może zwiększyć intensywność pożaru w kontakcie z materiałami palnymi. Chłodne pojemniki i rozlany materiał z dużą ilością wody.
profil bezpieczeństwa
potwierdził działanie rakotwórcze z eksperymentalnymi danymi dotyczącymi nowotworów. Zatrucie przez spożycie, dożylne, podskórne iintramuscular dróg. Eksperymentalteratogen. Inne eksperymentalne efekty reprodukcyjne. Raport z mutacji u ludzi. Potężny utleniacz. Po podgrzaniu dokompozycji emituje toksyczne opary K2O. stosowany jako zaprawa do wełny, w utlenianiu i obróbce barwników na materiałach. Zobacz też związki chromu.
potencjalna ekspozycja
chromian potasu jest stosowany w druku: obróbka fotomechaniczna; produkcja chromowo-pigmentowa; i metody konserwacji wełny; do wytwarzania barwników, pigmentów, atramentów i emalii; jako środek utleniający; odczynnik analityczny; w galwanizacji; Materiały wybuchowe.
Wysyłka
un1479 ciało stałe utleniające, N. O. s., Klasa Zagrożenia: 5.1; etykiety: 5.1-utleniacz, wymagana nazwa techniczna. UN3288 toksyczne ciała stałe, nieorganiczne, N. O. S., Klasa Zagrożenia: 6.1; etykiety :6.1-materiały trujące, wymagana nazwa techniczna
metody oczyszczania
krystalizują je z wody przewodności (0,6 g/mL przy 20o) i suszą między 135o a 170o.
niezgodności
Silny utleniacz. Gwałtowne reakcje z substancjami palnymi, organicznymi, sproszkowanymi metalami lub łatwo utleniającymi się substancjami. Kontakt z hydroksyloaminą, hydrazyna powoduje eksplozję.