Struktura molekularna ujawnia, jak działa antybiotyk streptomycyna / BNL Newsroom
Struktura molekularna ujawnia, jak działa antybiotyk streptomycyna
wrzesień 5, 2013
streptomycyna była pierwszym antybiotykiem opracowanym do leczenia gruźlicy jeszcze do niedawna naukowcy nie do końca rozumieli, jak działa na poziomie molekularnym. Wiedzieli, że streptomycyna blokuje krytyczny proces, syntezę białek przez rybosomy prowadzące do śmierci komórek bakteryjnych, ale pewne szczegóły interakcji pozostały nieodkryte. W Narodowym Synchrotronowym źródle światła w Brookhaven National Laboratory naukowcy wykorzystali krystalografię rentgenowską do wykonania obrazu.
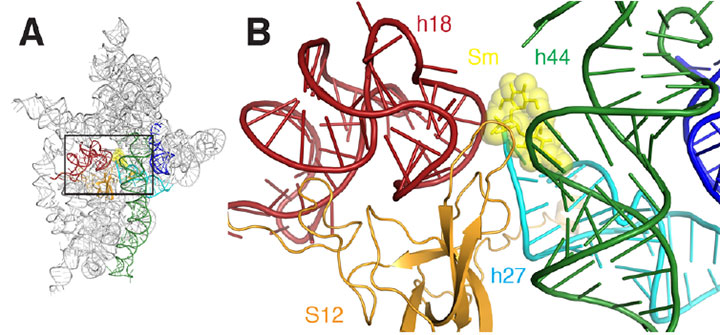
a) schemat wstęgi miejsca wiązania streptomycyny rybosomu. B) zbliżenie prostokątnego obszaru zarysowanego w A. streptomycyna jest reprezentowane jako żółte łuski i kule, helisy są koloru czerwonego, ciemnozielonego, cyjanowego, pomarańczowego i niebieskiego.
streptomycyna jest członkiem rodziny antybiotyków, które działają poprzez przerwanie funkcji rybosomów komórek bakterii, złożonych maszyn molekularnych, które tworzą białka poprzez łączenie aminokwasów ze sobą. Rybosomy, główny cel dla antybiotyków, które działają poprzez hamowanie syntezy białek, mają dwie główne części lub ” podjednostki.”
większa podjednostka buduje białko, kierując się rodzajem RNA zwanym messenger RNA (mRNA), który wiąże się z nim. Mała podjednostka „odczytuje” mRNA i wybiera dopasowaną cząsteczkę transferu RNA (tRNA), która wybiera i dostarcza następny aminokwas do rybosomu. Tutaj rolę odgrywa streptomycyna. Wiąże się blisko małej podjednostki, powodując poważne błędne odczytanie sekwencji. Powoduje to syntezę losowych białek, które ostatecznie zabijają bakterie. Jednak to, jak doszło do tego błędnego odczytania, pozostało tajemnicą, aż do niedawnych badań naukowców z Uniwersytetu Browna i multi-institution Northeastern Collaborative Access Team w Argonne National Laboratory (zarządzanym przez Cornell University).
tworząc kryształ-uporządkowaną strukturę identycznych jednostek – małej podjednostki rybosomalnej związanej z mRNA w obecności streptomycyny, naukowcy wygenerowali kilka szczegółowych „migawek”, które ujawniły kluczowe szczegóły interakcji na poziomie molekularnym, ostatecznie pokazując, jak streptomycyna upośledza funkcję podjednostki. W nsls beamline X25 zastosowali technikę zwaną krystalografią rentgenowską, w której wiązka promieni rentgenowskich jest skierowana na kryształ, wchodzi w interakcje z cząsteczkami i daje skomplikowany wzór dyfrakcyjny. Ze wzoru, za pomocą oprogramowania komputerowego, Grupa skonstruowała wizualne reprezentacje kompleksu podjednostki-mRNA-streptomycyny.
krótko mówiąc, naukowcy mogli „zobaczyć” po raz pierwszy subtelne sposoby, w jakie streptomycyna zniekształca strukturę miejsca dekodowania podjednostki, powodując nieprawidłowe odczytywanie mRNA. Na przykład Wiązanie streptomycyny zmniejsza odległość między dwiema z wielu Helis tworzących strukturę molekularną podjednostki. Jest to szczególnie istotne, ponieważ te helisy tworzą rzeczywiste miejsce dekodowania, a dekodowanie odbywa się poprawnie tylko wtedy, gdy elementy te są zorientowane dokładnie w stosunku do mRNA i wybranego tRNA. Wiązanie streptomycyny powoduje również zmianę relacji między jedną z tych dwóch Helis a trzecią helisą, powodując, że jedna z nich wycofuje się od drugiej lub „odłącza się”.”
rezultatem wszystkich tych drobnych zmian jest to, że streptomycyna destabilizuje wiązanie między podjednostką a” prawidłowym „tRNA, jednocześnie stabilizując Wiązanie podjednostki z” niewłaściwym ” tRNA, skutecznie usuwając dyskryminację między prawidłowym a niewłaściwym tRNA. Powoduje to spustoszenie w bakteryjnym łańcuchu dostaw nowych białek, zakłócając reprodukcję bakterii i cykl życia.
„nasze badania strukturalne wykazały, że streptomycyna indukuje zaskakująco duże zniekształcenia w rybosomie bakteryjnym, które pomagają nam zrozumieć, w jaki sposób ten antybiotyk zakłóca syntezę białek w bakteriach”, powiedział główny badacz Gerwald Jogl, profesor biologii w dziale Biologii Molekularnej Browna, Biologii Komórki & Biochemia. „Kontynuując nasze obecne odkrycia, badamy teraz, w jaki sposób mutacje w rybosomach bakteryjnych mogą przeciwdziałać tym strukturalnym rearanżacjom i umożliwić bakteriom przetrwanie śmiertelnego działania streptomycyny.”
to badanie zostało opublikowane w wydaniu Nature Communications z 15 stycznia 2013 pod tytułem ” a structural basis for streptomycin-induced misreading of the genetic code.”Wsparcie pochodziło od krajowych Instytutów Zdrowia i Departamentu Energii.
2013-4251/INT | EXT / Newsroom