Artigo
João Plante*, Chelsea Eason, Alan Snyder, Dirk Elston
Departamento de Dermatologia e Cirurgia Dermatológica, da Universidade de Medicina da Carolina do Sul, Charleston, Carolina do Sul
Líquen planopilaris (LPP) é uma alopecia cicatricial primária caracterizada por prurido, sensibilidade, folicular espinhos e eritema no active fase1-3. Embora a etiologia precisa seja desconhecida, a patogênese envolve inflamação crônica, mediada por linfócitos,que pode, em última análise, levar à perda irreversível de cabelo, cicatrizando através de sua destruição seletiva do folículo piloso 1, 2. Três variantes do LPP existem e incluem a forma clássica, alopecia de fibrosação frontal (FFA), e síndrome de Graham-Little-Piccardi-Lassueur (alopecia progressiva do couro cabeludo, axilas, sobrancelhas e púbis) 2. A LPP é muitas vezes refractária às terapias padrão e segue um curso imprevisível, recidivante, levando frequentemente a uma qualidade de vida severamente diminuída 1,2,4,5. Aqui discutimos ainda o nosso estudo recente sobre a utilização de tofacitinib no tratamento da recalcitrante LPP6.
foram utilizadas numerosas terapêuticas para tratar a PPL com sucesso variável 1-3,5,7-9. Uma vez que os tratamentos actualmente disponíveis não conduzem normalmente ao crescimento do cabelo, o controlo é dirigido para diminuir a taxa de perda de cabelo, controlar os sintomas e reduzir a inflamação2, 9. Terapias de primeira linha incluem corticosteróides tópicos intralesionais e de alta potência, mas estes podem resultar em atrofia do couro cabeludo e comprometer o sucesso do futuro Transplante Capilar. Outros agentes tópicos têm menor risco de atrofia e incluem os inibidores da calcineurina tacrolimus e microlimus2. Embora não controle o processo inflamatório subjacente, tanto o minoxidil tópico e oral também pode ser usado para maximizar o crescimento do cabelo em pacientes que também sofrem de padrão hereditário alopecia – quase 50% da população 9,10. Outras terapêuticas sistémicas incluem hidroxicloroquina, micofenolato de mofetil, ciclosporina, metotrexato, talidomida, doxiciclina, retinóides, pioglitazona, inibidores da redutase 5-alfa e prednisolone1,2,9 de curto prazo. Estudos recentes sugeriram o potencial da naltrexona oral de dose baixa, injecções plasmáticas ricas em plaquetas e intervenções não farmacológicas como o laser excimer, mas nenhuma foi uniformemente eficaz 5, 7,8. Embora os pedaços de cabelo e as extensões possam aumentar o volume e cobrir áreas alopecicas, deve ter-se cuidado para evitar a tração9.
num estudo recentemente publicado, investigámos o potencial das formulações tópicas e orais (sistémicas) de tofacitinib6. Tofacitinib é um inibidor da Janus kinase (JAK) 1/3 com eficácia contra várias condições dermatológicas mediadas pelo sistema imunitário, incluindo dermatite atópica, alopecia areata e vitiligo11-14. A sua actividade imunomoduladora é mediada através da inibição da pathway12,13 sinalizadores JAK/STAT. Na PPL, os interferões têm sido implicados em facilitar o recrutamento linfocítico e a perda do privilégio imunológico das células epiteliais de bulge1. Através dos efeitos do tofacitinib na Via JAK/STAT, esta inflamação mediada pelo interferão pode ser reduzida, melhorando assim os sintomas e prevenindo a destruição folicular maia1,11-13.
explorámos o potencial terapêutico de tofacitinib no tratamento da PPL refractária através de uma revisão retrospectiva de gráficos 6. Tanto quanto é do conhecimento dos autores, Este é o segundo estudo que investiga a utilização do tofacitinib na gestão do LPP 1. O nosso estudo incluiu nove doentes que tinham falhado outro tratamento – três tópicos usados, cinco orais usados, e um usou ambas as formulações.
foi atingida uma resposta inicial favorável em todos os doentes, excepto um. O restante indivíduo respondeu mal à terapia tópica, mas melhorou com a terapia sistémica do tofacitinib. Embora o número absoluto de pacientes seja pequeno, houve uma tendência para uma melhor resposta clínica em aqueles em sistêmico em comparação com aqueles em terapia tópica. O tempo para uma resposta favorável variou de 1 a 7 meses, com 5 e 8 doentes a demonstrarem melhoria nos primeiros 3 e 5 meses de tratamento, respectivamente.
o nosso padrão de prática actual é o tratamento rápido da doença progressiva com um curto ciclo de prednisona ou ciclosporina e depois tentar a transição para terapêutica tópica com inibidor da calcineurina, quando possível (Figura 1). Um subgrupo de doentes irá atingir a remissão da sua doença com pioglitazona em doses de 15-45 mg por dia. Os doentes devem ser avisados da indicação etiquetada, de dados mistos relativos à eficácia e de advertências encaixotadas sobre o cancro da bexiga com uso prolongado. A nossa prática não é continuar a pioglitazona após um máximo de 9 meses com doses crescentes em incrementos. Os agentes adjuvantes incluem a naltrexona numa dose de 5 mg por dia e a N-acetilcisteína em doses de 600-1200 mg três vezes por dia. O laser Excimer, UVB de banda estreita e de baixa intensidade, é frequentemente utilizado como terapia adjuvante naqueles com resposta parcial. A hidroxicloroquina pode, ocasionalmente, ser benéfica, mas a maioria dos pacientes referidos à nossa clínica já falharam na terapia da hidroxicloroquina. Os que não responderem podem necessitar de tratamento com metotrexato, micofenolato de mofetil ou tofacitinib. Os resultados do nosso estudo recente dão um apoio adicional à ideia de que tanto o tofacitinib tópico quanto sistêmico pode ser modalidades de tratamento adjuvante viáveis em casos refratários. Os distúrbios Capilares geralmente respondem lentamente, e nós reavaliamos em intervalos de 3 meses para determinar a resposta à terapia e necessidade de escalada.
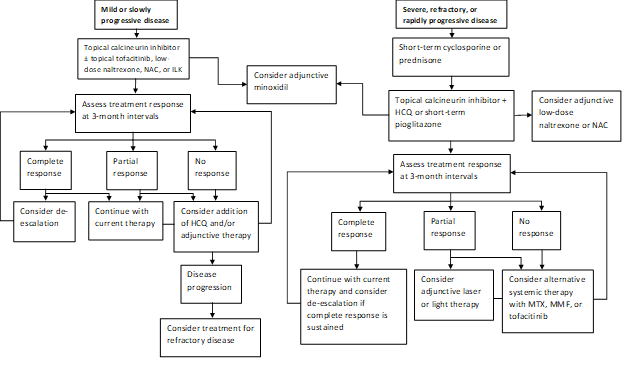
Figura 1: algoritmo de tratamento gradual para LPP
NAC, N-acetilcisteína; ILK, corticosteróides intralesionais; HCQ, hidroxicloroquina; MTX, metotrexato, FMM, micofenolato de mofetil
quando se considera o uso de tofacitinib na prática, os profissionais devem equilibrar os benefícios deste medicamento com os seus riscos. A nossa coorte apresentou apenas pequenas anomalias laboratoriais (uma sobre tópico e duas sobre terapia sistémica) que não necessitaram de intervenção. No entanto, os prestadores devem estar cientes dos potenciais efeitos secundários ao prescreverem este medicamento, incluindo um risco aumentado de infecção, citopenias, hiperlipidemia, anomalias hepáticas e renais, bem como o potencial para acontecimentos tromboembólicos14-16. Embora a formulação tópica tenha demonstrado concentrações plasmáticas mais baixas do que a sua contraparte sistémica, foram ainda notificados pequenos acontecimentos adversos e anomalias laboratoriais com terapêutica tópica13.
embora os nossos resultados sejam promissores, devem ser interpretados após considerar várias limitações. Nós usamos um projeto de estudo retrospectivo, e não fomos capazes de empregar uma medida validada de gravidade da doença, como o Índice de atividade Lichen Planopilaris (LPPAI)1,3. A LPPAI é adequada para estudos prospectivos e fornece uma ferramenta padronizada pela qual os Provedores podem comparar diretamente os resultados através de várias modalidades de tratamento. Foram utilizados sinais e sintomas como eritema, sensibilidade, presença de espinhos foliculares e área afectada para avaliar a resposta terapêutica, mas os estudos futuros devem também incluir uma medida da qualidade de vida. A possibilidade de viés observador não pode ser excluída, pois nosso estudo foi não-linded e não-randomizado.
além disso, toda a nossa coorte utilizava para facilitar o acesso, dificultando a avaliação da contribuição independente da droga. Em um estudo anterior, uma porção (N=5) da coorte usada tofacitinib como monoterapia, e a maioria dos indivíduos alcançou resultados favoráveis, mas este estudo também foi limitado por seu pequeno tamanho de amostra e design retrospectivo 1.
os estudos actuais são limitados pelas suas pequenas dimensões de amostras e desenhos de estudos retrospectivos, e estudos prospectivos bem concebidos são muito necessários. Aconselhamos uma abordagem gradual à terapia para minimizar o risco de efeitos adversos. O risco de cicatrização permanente deve ser ponderado contra o risco de acontecimentos adversos graves à luz de factores e co-morbilidades individuais do doente, e os doentes devem ser parceiros activos na tomada de decisão. A transplantação de cabelo pode ser considerada uma vez atingido o controlo da doença e a inflamação diminuiu. É importante notar que a terapêutica agressiva, como a prednisona ou a ciclosporina, é tipicamente necessária durante as semanas seguintes ao transplante para evitar erupções de doença. É de esperar um desgaste Gradual dos pêlos transplantados, mesmo após um transplante bem sucedido, mas os dados sugerem que os doentes estão geralmente satisfeitos com os resultados e que o transplante melhora a qualidade de vida.
abreviaturas
LPP, lichen planopilaris; FFA, alopecia de fibrosagem frontal; JAK, Janus kinase; STAT, transdutor de sinal e activador de proteínas de transcrição; LPAI, Lichen Planopilaris Activity Index.
conflitos de interesses
os autores não declaram conflitos de interesses.
- Yang CC, Khanna T, Sallee B, et al. Tofacitinib for the treatment of lichen planopilaris: a case series. Dermatol Ther. 2018; 31 (6): e12656. doi: 10.1111 / dth.12656
- Babahosseini H, Tavakolpour s, Mahmoudi H, et al. Lichen planopilaris: estudo retrospectivo sobre as características e o tratamento de 291 doentes. J Dermatolog Treat. 2019; 30(6): 598–604. doi:10.1080/09546634.2018.1542480
- Chiang C, Sah D, Cho BK, et al. Hydroxychloroquine and lichen planopilaris: efficacy and introduction of Lichen Planopilaris Activity Index scoring system. J Am Acad Dermatol. 2010; 62(3): 387-392. doi: 10.1016 / j. jaad.2009.08.054
- Alirezaei P, Ahmadpanah M, Rezanejad A, et al. Em comparação com os controles, os indivíduos com líquen Planopilaris têm mais Depressão, menor auto-estima e menor qualidade de vida. Neuropsicobiologia. 2019; 78(2): 95-103. doi:10.1159/000499135
- Jai AK. Plasma rico em plaquetas como tratamento adjuvante no líquen planopilaris. J Am Acad Dermatol. 2019; 80(5): e109-e110. doi: 10.1016 / j. jaad.2018.09.013
- Plante J, Eason C, Snyder A, et al. Tofacitinib in the treatment of lichen planopilaris: a retrospective review . J Am Acad Dermatol. 2020; S0190-9622 (20)30979-8. doi:10.1016 / j. jaad.2020.05. 104
- Lajevardi V, Salarvand F, Ghiasi M, et al. A eficácia e segurança da dose oral baixa de naltrexona versus placebo nos doentes com lichen planopilaris: um ensaio clínico controlado aleatorizado . J Dermatolog Treat. 2020; 1-5. doi:10.1080/09546634.2020.1774488
- Lee B, Elston DM. A utilização de naltrexona em condições dermatológicas. J Am Acad Dermatol. 2019; 80(6): 1746-1752. doi: 10.1016 / j. jaad.2018. 12. 031
- Bolduc C, Sperling LC, Shapiro J. primária alopécia cicatricial: Alopécia cicatricial primária linfocítica, incluindo lúpus eritematoso cutâneo crónico, lichen planopilaris, alopecia fibrótica frontal e síndrome de Graham-Little. J Am Acad Dermatol. 2016; 75(6): 1081-1099.
- Vano-Galvan S, Trindade de Carvalho L, Saceda-Corralo D, et al. O minoxidil Oral melhora a espessura do cabelo no líquen planopilaris . J Am Acad Dermatol. 2020; S0190-9622 (20)30566-1. doi: 10.1016 / j. jaad.2020.04.026
- Tegtmeyer K, Zhao J, Maloney NJ, et al. Estudos Off-label on tofacitinib in dermatology: a review . J Dermatolog Treat. 2019; 1–11. doi: 10.1080/09546634.2019.1673877
- Montilla AM, Gomez-Garcia F, Gomez-arias PJ, et al. Scoping Review on the Use of Drugs directing JAK/STAT Pathway in Atopic Dermatite, Vitiligo, and Alopecia Areata. Dermatol Ther (Heidelb). 2019; 9(4): 655–683. doi:10.1007/s13555-019-00329-y
- Hosking AM, Juhasz M, Mesinkovska NA. Tópica Janus kinase inhibitors: A review of applications in dermatology. J Am Acad Dermatol. 2018; 79(3): 535–544. doi: 10.1016 / j. jaad.2018.04.018
- Shreberk-Hassidim R, Ramot Y, Zlotogorski A. Janus kinase in dermatology: a systematology review. J Am Acad Dermatol. 2017; 76(4): 745-753.e19. doi: 10.1016 / j. jaad.2016. 12. 004
- Xeljanz / Xeljanz XR (tofacitinib) . New York, NY: Pfizer Laboratories Division of Pfizer Inc. https://labeling.pfizer.com/showlabeling.aspx?id=959; 2019. Accessed July 7, 2020.
- FDA. O ensaio de segurança detectou risco de coágulos sanguíneos nos pulmões e morte com uma dose mais elevada de tofacitinib (Xeljanz, Xeljanz XR) em doentes com artrite reumatóide; FDA para investigar. https://www.fda.gov/drugs/drug-safety-and-availability/safety-trial-finds-risk-blood-clots-lungs-and-death-higher-dose-tofacitinib-xeljanz-xeljanz-xr; 2019. Accessed July 6, 2020.