Bioorganic & Química Orgânica
Hydroboration–reação de oxidação
cei além de diborane para um alkene bond fornece um útil extremamente método de hidratação. O diborano pode ser gerado pela adição de borohidreto de sódio ao trifluoreto de boro em tetrahidrofurano ou éter a 0o-5oC. Diborano é o dímero de Borano (BH3) e é a forma estável deste reagente (Scheme1).
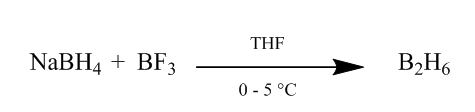
Figura 1 Obtenção de Diborane de boro-hidreto de sódio
A adição de diborane para o alkene é extremamente rápido e, geralmente, o reagente adiciona menos impedido de as duas faces de π do sistema. A adição da cis foi racionalizada por um estado de transição de quatro centros. O complexo Borano resultante da adição de diborano a um alceno é convertido, com retenção de estereoquímica, a um álcool por tratamento com peróxido de hidrogênio básico. Thus 1-methylcyclohexene 1 on hydroboration-oxidation leads the formation of trans-2-methylcyclo-hexanol 2. O caminho mecanicista foi descrito em (Esquema 2). O método para a conversão de alceno em álcool por hidro-oxidação foi aplicado para a síntese de muitos produtos naturais. Alguns exemplos são ilustrados abaixo.

Figura 2 mecanismo de Reação para a formação de trans-2-methylcyclohexanol 2
Síntese do (±) junenol e (±) acalomone
O uso de hydroboration-reação de oxidação foi observada por Banerjee e colegas de trabalho durante o synthesis3 de eudesmone sesquiterpenos (±) junenol e (±) acalomone. A fim de obter a síntese destes sesquiterpenos, o alceno 3, foi selecionado como material de base e submetido a oxidação por hidroboração para produzir o álcool 4 (Esquema 3). A cetona 5, obtida pela oxidação do álcool com reagente de Jones 4, foi feita para reagir com carbonato de dietilo. O produto resultante foi tratado com metil lítio para obter o CETOL 6 cuja conversão à isopropilcetona 7 foi efectuada por desidratação e hidrogenação, respectivamente. A redução do hidreto metálico da cetona seguida pela oxidação com tetraacetato de chumbo 5 em ciclo-hexano permitiu o éter cíclico 8, que foi convertido em cetoacídeo 9 por oxidação com ácido crômico e ácido acético. Descarboxilação com tetraacetato de chumbo em benzeno e piridina, seguida de purificação em mais de 10% de gel de sílica impregnada AgNO3 proporcionado (±) apolamona 10. Redução da acolamona 10 com borohidrido de sódio em metanol, seguida de sublimação do produto resultante, obtido junenol 11.
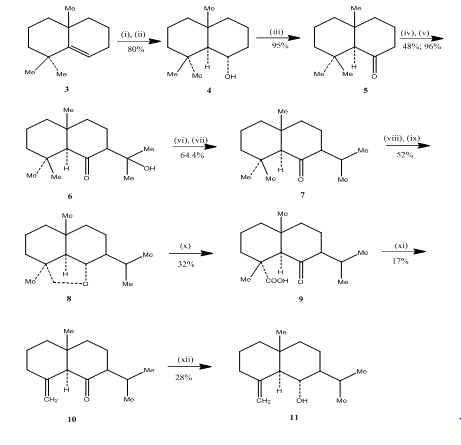
Figura 3-Síntese de eudesmone sesquiterpenos (±) junenol e (±)-acalomone
Reagentes: (i) BF3.Et2O, NaBH4, THF, 0 E 5°C; (ii) NaOH (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) NaH, CO(OEt)2, DME; (v) MeLi, Et2O, refluxo, 2h; (vi) HCl(conc), MeOH; (vii) H2, PtO2, MeOH; viii) na, EtOH, reflux; ix)Pb (OAc) 4, C6H12; x) CrO3, AcOH; xi)Pb(OAc) 4, C6H6, Py, reflux; xii) NaBH4, EtOH.
síntese do ácido pisiferico
a utilização de oxidação por hidroboração foi registada durante a síntese do ácido pisiferico 6,um diterpeno tricíclico que mostra actividades antibacterianas contra todas as bactérias gram-positivas testadas.7 a via sintética foi descrita no Esquema 4. Hydroboration-oxidation of the alkene 13, prepared from the known8 ketoalcohol 12, was oxidized with jones reagent4 and reduced respectively with metal hydride to give alcohol 14. Oxidação com tetraacetato de chumbo em benzeno com 250W lâmpada de tungsténio deu ao éter cíclico 15. A clivagem do éter cíclico com zinco, iodeto de zinco e ácido acético8 forneceu pisiferol 16. A transformação do pisiferol no éster 17 foi conseguida em seis etapas:
- Metilação com dimetil sulfato
- Oxidação com reagente de jones
- Esterificação com diazomethane
- Redução com boro-hidreto de sódio
- Tosylation
- Detosylation
O éster l7 foi convertido em pisiferic ácido 18 por aquecimento com brometo de alumínio e etano thiol.
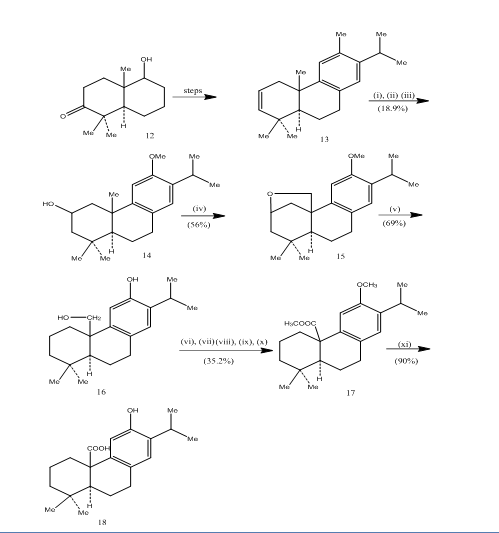
Figura 4-Síntese de pisiferic ácido 18
Reagentes: (i) BF3.Et2O, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv) Pb(OAc)4, CaCO3, C6H6, 250w lâmpada de tungstênio; (v) Zn, ZnI, MeCOOH; (vi) MeSO4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; (ix) NaBH4, MeOH; (x) TsCl, Py; (xi) NaI, Zn poeira, DMF; (xii) AlBr3, (CH2SH)2.
a reacção de oxidação por hidroboração foi aplicada para a síntese de ( ± ) eudes-4(14),7(11)-diene-8-one, 9 taxodione, 10 norditerpene alcohols11 e muitos outros terpenes.12 estes exemplos indicam claramente o uso de eterato de tifluoreto de boro na conversão dos alcenos em álcoois e subsequentemente suas transformações nos compostos terpenóides.
clivagem de epóxidos
os epóxidos podem ser clivados por vários reagentes. O eterato de borontrifluoreto de ácido de Lewis também tem sido usado para a clivagem de epóxidos e, em muitos casos, o produto resultante rearranja para cetona. A clivagem de epóxidos também é acompanhada por ciclização. Nesta revisão, foi discutida a clivagem de alguns epóxidos com eterato de trifluoreto de boro e a utilização dos produtos resultantes na síntese de produtos naturais.
Síntese de 6-metoxi-2-tetralone
A clivagem de epóxidas com trifluoreto de boro eterato foi utilized13 para a síntese de 6-metoxi-2-tetralone 20 (Esquema 5), um importante selecionado material de partida para a síntese de muitos compostos orgânicos. A epoxidação do alqueno13 19, seguida do tratamento do produto bruto em diclorometano com trifluoreto de boro eterato, proporcionou a tetralona 20 em 36% de rendimento. Quando a clivagem foi experimentada com ácido sulfúrico, o Rendimento da teralona 20 foi melhorado (39%), juntamente com a formação de outros produtos secundários e, portanto, a purificação cromatográfica foi muito trabalhosa.
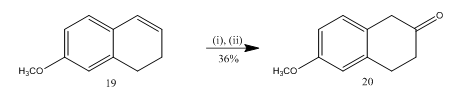
Figura 5-Síntese de 6-metoxi-2-tetralone 20
Reagentes: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
Síntese de cuprane
O rearranjo de epóxidos por trifluoreto de boro eterato se mostraram muito úteis durante o synthesis14 de sesquiterpene cuprane. A via sintética é descrita no esquema 6. 6,6-dimetil-1-p-tolylcyclohexene 21 na epoxidação concedida a epóxidas 22 em bom rendimento que o tratamento com trifluoreto de boro eterato em benzeno obteve-se o aldeído 23 de baixo rendimento. A semicarbazona do aldeído foi aquecida com hidróxido de potássio para fornecer o 24 sesquiterpeno em rendimento aceitável. A síntese é atraente devido à sua brevidade em etapas. As condições utilizadas para o rearranjo do epóxido 22 são críticas porque tem a tendência de sofrer um rearranjo adicional para a cetona 25.
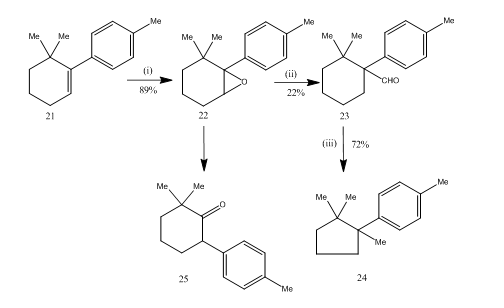
Figura 6-Síntese de cuprane
Reagentes: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
Síntese do (±) karahana éter
trifluoreto de Boro eterato foi também utilizado para a clivagem de epóxidas durante o synthesis15 de karahana éter, um volátil monoterpene que foi isolated16 de Japonês saltos. A via sintética é descrita no esquema 7. O epóxido 27, obtido do dieno 26, ao ser tratado com eterato de trifluoreto de boro, foi submetido a ciclização, produzindo o produto 28. A ciclização provavelmente ocorreu através do intermediário 27 (I). A redução do hidreto metálico deu diol que na tosilação rendeu karahanaether 29. O rendimento é indeterminado. A clivagem de epóxidos tem sido utilizada para a síntese de muitos terpenos como rosenolactona,17 cyperolona,18 maritimol.19
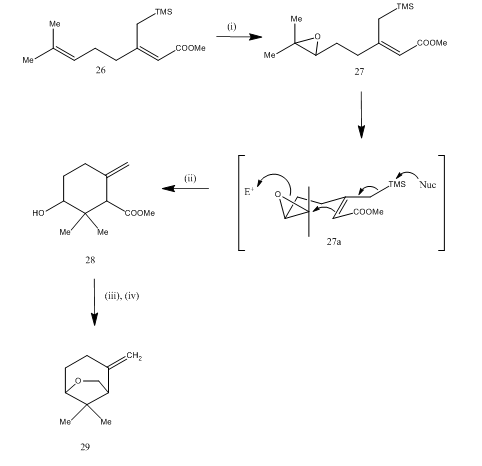
Figura 7-Síntese do (±) Karahana éter
Reagentes: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
Esterificação
Esterificação é frequentemente utilizado de reação para a síntese de muitos compostos orgânicos. Trifluoreto de boro etherato-álcool é um reagente muito conveniente para a esterificação de muitos ácidos p-amino benzoicos, aromáticos, heterocíclicos e insaturados.20 em algumas reações de esterificação o uso deste reagente forneceu um rendimento superior em comparação com outros reagentes. Alguns exemplos são dados no esquema 8. Os ácidos 30-32 foram convertidos para os ésteres 33-35, respectivamente, em alto rendimento no tratamento com reagente eterato-álcool de boro trifluoreto. Marshall and collaborators21 used the same reagent for the esterification of carboxylic acids. Dymicky22 preparou vários formatos em alto rendimento de ácido fórmico e álcool na presença de uma quantidade catalítica de complexo trifluoreto de boro-metanol. Os outros catalisadores, por exemplo, ácido sulfúrico, ácido p-tolueno sulfónico, não eram tão eficientes como o complexo trifluoreto de boro – metanol.
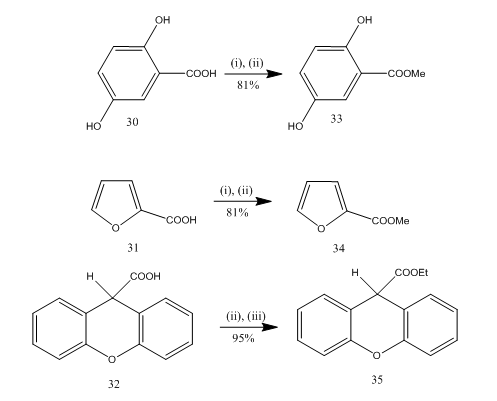
Figura 8 esterificação dos ácidos 32-35
reagentes: (I) MeOH; (ii) BF3.Et2O; (iii) EtOH
Jackson e collaborators23 desenvolveram um método eficiente para a conversão de álcoois 37-39 e ácidos 40-42 diretamente para o correspondente t-butil derivados em bom rendimento usando t-butil trichloroacetimidate 36 na presença de uma quantidade catalítica de trifluoreto de boro eterato como exibido no Esquema 9. Este método funciona melhor com os grupos sensíveis ao ácido do que os métodos tradicionais usando isobuteno. O grupo hidroxilo menos dificultado de um diol pode ser protegido e também é acessível a trabalhos em pequena escala (evitando a entrega de isobuteno gasoso). O 2,2,2-tricloroacetimidato de t-butilo 36 é prontamente preparado pela adição de t-butanol ao tricloroacetonitrilo. A maioria dos experimentos foram realizados na presença de uma mistura de diclorometano e ciclohexano. Anidrido acético em presença de trifluoreto de boro etherato tem sido utilizado para a acetilação do grupo hidroxilo.24

Figura 9 conversão de álcoois e ácidos a partir de derivados t-butílicos.
reagentes: 36, (i) BF3.Et2O, (ii) CH2Cl2, C6H12
Cyclization
O trifluoreto de boro eterato tem desempenhado um papel importante na cyclization de muitos, ácidos carboxílicos, allenes etc. Os seguintes exemplos ilustrarão o papel do trifluoreto de boro como agente ciclizante. O cloreto de ácido 49 e o alceno 50 foram condensados para produzir divinilcetone25 51, que foram submetidos a ciclização Nazarov 26, 27 fornecendo cetona cíclica 52, que foi convertida para o sesquiterpeno trichodiene 53 (esquema 10).
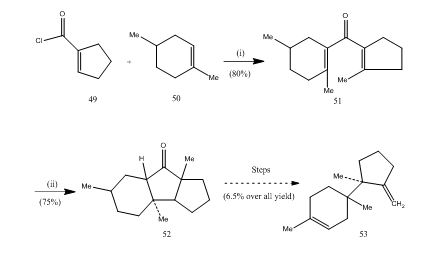
Figura 10-Síntese de sesquiterpene trichodiene 53
Reagentes: (i) SnCl4, NaOMe; (ii) BF3Et2O
Vários allenyl teluretos aromáticos cetonas sofrer cyclization com trifluoreto de boro eterato proporcionando metileno benzocyclopentenone através de um novo 5-endo-modo de cyclization.28 as cetonas 54-56 forneceram benzociclopentenonas 57-59, respectivamente (regime 11). Provavelmente a transformação ocorreu como mostrado na ciclização de allenyl AYL ketone 54 em 57. Pode-se observar que a presença de grupos substituintes em anel aromático determina o rendimento do produto ciclizado. Kos e Loewenthal28 relatou o cyclization do ácido 60 com trifluoreto de boro eterato para a cetona 61, que foi convertido gibberone 62 (Esquema 12), em três passos:
- Ketalization
- Huang-Minlon redução e
- hidrólise Ácida. O acima mencionado exemplos apresentam o uso de trifluoreto de boro eterato no cyclization de compostos orgânicos
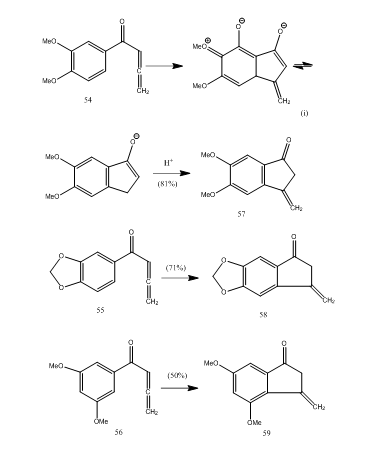
Figura 11-Síntese de Cyclopentenones

Figura 12-Síntese para gibberone
Reagentes: (i) BF3.Et2O; (ii) (a) C2H6O2; (b) GRAUS, N2H4, KOH, 190-200°C; (c) H+