Educação no cérebro
embora estejamos aprendendo mais a cada dia sobre a fisiopatologia da doença de Parkinson, ela ainda é considerada em grande parte idiopática (de causa desconhecida). É provável que envolva a interacção entre a susceptibilidade ao hospedeiro e os factores ambientais. Uma pequena percentagem dos casos está geneticamente ligada e os factores genéticos estão a ser intensamente estudados.Fisiologicamente, os sintomas associados à doença de Parkinson são o resultado da perda de vários neurotransmissores, principalmente dopamina. Os sintomas pioram com o tempo à medida que mais e mais das células afetadas pela doença são perdidos. O curso da doença é altamente variável, com alguns pacientes exibindo muito poucos sintomas à medida que envelhecem e outros cujos sintomas progridem rapidamente.
Parkinson é cada vez mais visto como uma doença neurodegenerativa complexa com uma sequência de progressão. Há fortes evidências de que primeiro afeta o núcleo motor dorsal do nervo vago e os bolbos olfativos e o núcleo, em seguida, o locus coeruleus, e, eventualmente, a substância negra. As áreas corticais do cérebro são afectadas numa fase posterior. Os danos a estes vários sistemas neuronais explicam as mudanças fisiopatológicas multifacetadas que causam danos não só ao sistema motor, mas também aos sistemas cognitivos e neuropsicológicos (Kwan & Whitehill, 2011).
O Papel da Dopamina
Dopamina, como outros neurotransmissores, transmite mensagens químicas a partir de uma célula nervosa para outra através da sinapse, um espaço entre a célula pré-sináptica e o receptor pós-sináptico. A dopamina é secretada na sinapse a partir de vesículas de armazenamento de membrana na membrana pré-sináptica. Atravessa a sinapse e liga-se à membrana pós-sináptica, onde activa os receptores dopaminérgicos. A dopamina não utilizada remanescente na sinapse é absorvida de volta para a célula pré-sináptica; uma vez de volta para a célula pré-sináptica, o excesso de dopamina é reembalado nas vesículas de armazenamento e liberado novamente para a sinapse.
dentro da sinapse, como a dopamina viaja de uma célula para outra, pode ser decomposta e tornada inactiva por duas enzimas, MAO (monoaminoxidase) e COMT (catecol-o-metil transferase). Uma estratégia terapêutica introduz um inibidor da MAO na sinapse, que interrompe a ação da enzima MAO e impede a decomposição da dopamina. Isto permite que mais dopamina permaneça na sinapse e aumenta a probabilidade de se ligar à membrana pós-sináptica.
transmissão sináptica Química
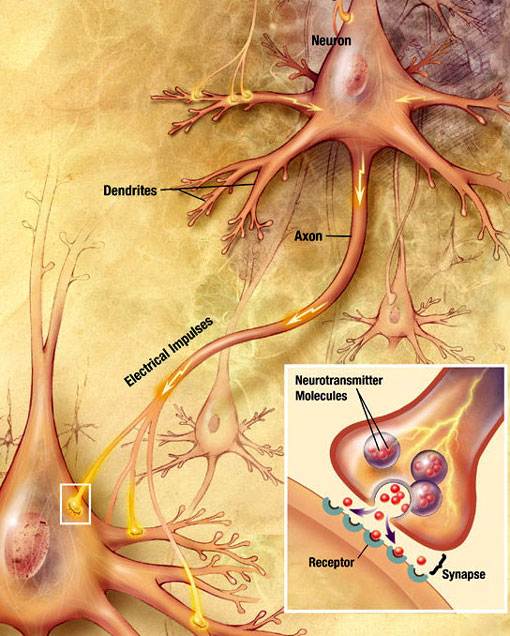
uma onda eletroquímica chamada potencial de ação viaja ao longo do axônio de um neurônio. Quando o potencial de Ação atinge o terminal pré-sináptico, provoca a libertação de uma pequena quantidade de moléculas neurotransmissoras, que se ligam a moléculas de receptores químicos localizadas na membrana do neurônio pós-sináptico, no lado oposto da fenda sináptica. Fonte: Wikimedia Commons.
perda progressiva de dopamina
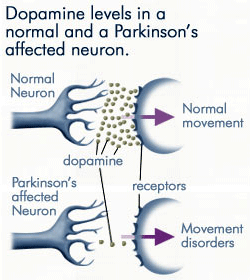
como a dopamina é cada vez menos produzida pelos neurónios afectados pela doença de Parkinson, existe muito menos dopamina disponível para se ligar aos receptores da dopamina na membrana pós-sináptica. Fonte: anti-agingfirewalls.com.
embora a perda de células da dopamina não possa ser medida directamente, as medições em pessoas neurologicamente normais e em primatas não humanos revelam uma lenta perda progressiva de dopamina com a idade. Na doença de Parkinson, a perda ocorre a uma taxa muito maior e tanto as medidas bioquímicas e estudos de imagem sugerem que há uma diminuição significativa na dopamina pelo tempo em que os sintomas motores aparecem. Nesta visão, a doença de Parkinson é uma versão acelerada da morte celular vista com o envelhecimento normal (Cookson, 2009). Isto é ilustrado no gráfico abaixo, que mostra o declínio dos neurônios dopaminérgicos durante o envelhecimento normal, na PD idiopática, na PD causada por fatores ambientais ou genéticos, e na PD de início precoce.
Evolução da Depleção de Dopamina na Doença de Parkinson
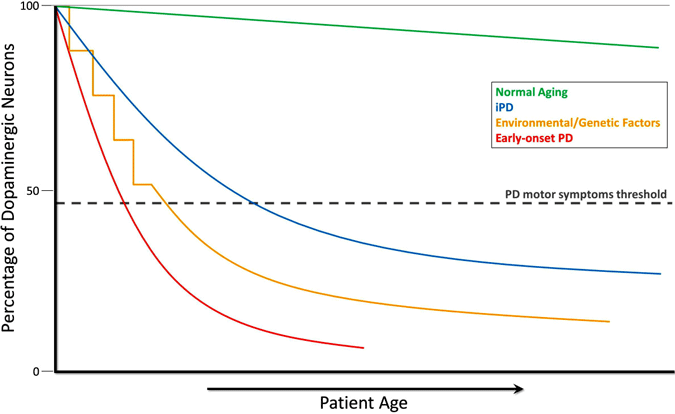
Durante o curso normal de envelhecimento (linha verde), pequeno, mas lenta degeneração dopaminérgica ocorre sem sintomas motores. PD idiopática (dpi, linha azul) é de origem desconhecida, mas acredita-se que se desenvolva gradualmente, com uma degeneração lenta de neurônios dopaminérgicos levando aos sintomas motores PD clássicos mais tarde na vida. Outro modelo de neurodegeneração dopamina que leva a sintomas motores de PD envolve exposição repetida a tóxicos ambientais ao longo do tempo, em combinação com uma predisposição genética à perda de neurônios dopaminérgicos (linha amarela). PD de início precoce (linha vermelha), como causada por mutações no gene PARKIN, envolve um declínio precipitado nos neurônios dopaminérgicos, e sintomas motores PD podem apresentar décadas antes dos da PD idiopática. Mais um cenário (não mostrado) de desenvolvimento de sintomas motores de PD envolve possíveis tóxicos ambientais In utero ou fatores genéticos levando a um número atipicamente baixo de neurônios dopaminérgicos no nascimento e maior susceptibilidade ao desenvolvimento de PD (Haas et al., 2012).
a degeneração dos neurónios dopaminérgicos é particularmente evidente numa parte da substância negra chamada pars compacta. Significativamente, a perda de dopamina no pars compacta aumenta o impulso excitatório geral nos gânglios basais,* interrompendo o controle motor voluntário e causando os sintomas característicos de PD. A normalização da função motora é observada inicialmente com tratamento com levodopa (Gasparini et al., 2013).
* os principais componentes dos gânglios basais são o estriato (núcleo caudado e putâmen), o globus pallidus, a substância nigra, o núcleo accumbens e o núcleo subtalâmico.
à medida que a gravidade da DP aumenta, a depleção de dopamina leva a novas alterações nas vias basais dos gânglios, incluindo a função alterada de outros neurotransmissores basais dos gânglios, tais como glutamato, GABA e serotonina (Gasparini et al., 2013). Embora haja relativa vulnerabilidade dos neurônios produtores de dopamina na substância negra, nem todas as células dopamínicos são afetadas na doença de Parkinson; em algumas partes do cérebro, os neurônios produtores de dopamina são relativamente poupados (Cookson, 2009).
a via Nigrostriatal
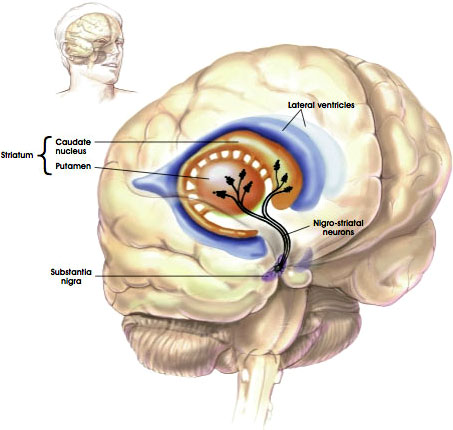
fonte: NIH, N. D..
corpos de Lewy e alfa-sinucleína
corpos de Lewy são agregados anormais e inclusões de proteínas que se desenvolvem dentro das células nervosas em pessoas com doença de Parkinson. As agregações consistem geralmente em agregados fibrilares insolúveis contendo proteínas mal dobradas. Um grande número de moléculas foram identificadas em corpos de Lewy, mas uma proteína chamada alfa-sinucleína é o componente principal.
corpos de Lewy (inclusões de Sinucleinas Alfa)
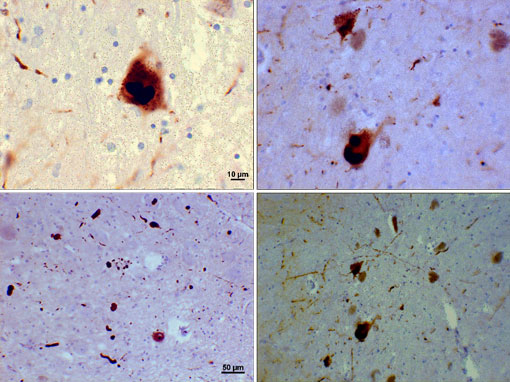
Photomicrograph of regions of substantia nigra in a Parkinson patient showing Lewy bodies and Lewy neurites in various magnifications. Os painéis superiores mostram uma ampliação de 60x das inclusões intraneuronais de alfa-sinucleína agregadas para formar corpos de Lewy. Os painéis de fundo são 20× imagens de ampliação que mostram neurites Lewy tipo cadeia e corpos Lewy arredondados de vários tamanhos. Imagens cortesia de Suraj Rajan.
a patologia de Lewy abrange muitas regiões do cérebro e alguns relatórios têm sugerido que a substância negra não é o primeiro lugar onde os corpos de Lewy se formam na doença de Parkinson. Inclusões e agregados provavelmente simbolizam a fase final de uma cascata de eventos complicados. Uma fase anterior pode estar mais diretamente ligada à patogênese da desordem do que as próprias inclusões, que podem ou não representar marcas de diagnóstico.
corpos de Lewy também são vistos em” demência com corpos de Lewy”, sugerindo que estas condições estão relacionadas umas com as outras por patologia compartilhada e possivelmente por etiologia compartilhada. Nem a perda celular nem a formação de corpos de Lewy é absolutamente específica para PD, mas ambos são necessários para um diagnóstico de PD sob as definições atuais (Cookson, 2009).
doenças Neurodegenerativas como a doença de Alzheimer, frontal, temporal degeneração, doenças priônicas, coreia de Huntington, e motoneuron doenças estão cada vez mais sendo realizado comuns celular e molecular de mecanismos, incluindo a proteína de agregação de inclusão e de formação do corpo em certas áreas do sistema nervoso (Jellinger, 2011).
inflamação e resposta imunitária
o gatilho da degeneração dopaminérgica parece ser multifactorial afectada por elementos endógenos e ambientais. A inflamação e as respostas imunitárias estão sendo cada vez mais consideradas como mediadores importantes da degeneração dopaminérgica. Grandes estudos populacionais têm sugerido que os indivíduos que tomam medicamentos anti-inflamatórios não esteróides (AINEs) têm menor risco de desenvolver DP idiopática, o que sugere que os medicamentos anti-inflamatórios podem ser um tratamento promissor modificador da doença para pacientes parkinsonianos (Barcia, 2013).
novas fases de ensaio envolveram tratamentos anti-inflamatórios – especificamente à procura de um biomarcador objectivo em tratamentos destinados a reduzir as alterações inflamatórias em doentes com DP. Os investigadores estão a utilizar ferramentas de neuroimaging para desenvolver um biomarcador relevante com a intenção de O testar em grandes ensaios clínicos de imagiologia. O resultado destes ensaios irá fornecer dados para testar e monitorizar a progressão dos tratamentos anti-inflamatórios para DP e irá ajudar a identificar a janela terapêutica oportuna para parar, ou pelo menos lenta, degeneração dopaminérgica mediada por inflamatórios (Barcia, 2013).
parkinsonismo
parkinsonismo, também conhecido como” Parkinson atípico”,” Parkinson secundária “ou” síndrome de Parkinson”, é uma síndrome neurologica na qual um paciente exibe alguns dos sintomas associados à doença de Parkinson—tremor, rigidez, bradiquinésia e instabilidade postural. Mas o parkinsonismo não é doença de Parkinson. Pensa-se que o parkinsonismo não seja causado pela doença de Parkinson e que os doentes respondem normalmente mal à intervenção farmacológica. O parkinsonismo muitas vezes tem uma causa identificável, como a exposição a toxinas, metanfetamina, trauma, derrames múltiplos, outras doenças do sistema nervoso, ou doença. Geralmente, corpos de Lewy não são vistos no parkinsonismo.
o termo parkinsonismo também está associado a distúrbios como paralisia supranuclear progressiva, atrofia múltipla do sistema, demência corporal de Lewy, degeneração corticobasal, parkinsonismo vascular, parkinsonismo induzido por drogas, e parkinsonismo secundário à infecção e outras causas (Hohler et al., 2012). Pode ocorrer uma forma de parkinsonismo reversível a partir do uso de certos neurolépticos, particularmente reserpina, antipsicóticos (haloperidol) e metoclopramida. A exposição a certas toxinas, envenenamento por monóxido de carbono e envenenamento por mercúrio também pode levar ao parkinsonismo.
O aparecimento, no início da década de 1980, de parkinsonismo sintomas em um grupo de viciados em drogas que consumiu um lote contaminado de um opiáceo sintético levou à descoberta da química MPTP como um agente que causa a síndrome de parkinsonismo em primatas não-humanos, bem como em seres humanos. O MPTP pode ser produzido quando se faz uma forma de heroína (o MPTP é convertido a uma neurotoxina que destrói selectivamente as células dopaminérgicas na substância nigra). Estes casos são raros e afectaram principalmente os consumidores de droga a longo prazo.
o abuso de metanfetaminas também tem sido ligado ao parkinsonismo. Em animais experimentais, a exposição à metanfetamina danifica as fibras dopaminérgicas no estriato*, bem como os corpos celulares na substância nigra, ecoando a degeneração observada em pacientes humanos com DP. Também foram observados danos selectivos nos terminais dopaminérgicos no estriato em consumidores humanos de metanfetaminas, embora não haja até agora provas de que o abuso de metanfetaminas danifique os corpos celulares dopaminérgicos na substância negra (Granado et al., 2013).
*o maior núcleo dos gânglios basais, o estriato consiste no núcleo caudado e no putâmen.Foi colocada a hipótese de que o consumo de metanfetaminas pode predispor os consumidores para o desenvolvimento futuro da DP. Esta hipótese tem sido apoiada por um trabalho epidemiológico recente que indica que os consumidores de metanfetaminas têm um risco aumentado de desenvolver DP. Isto é consistente com os efeitos neurotóxicos persistentes da metanfetamina em animais experimentais (Granado et al., 2013).
os doentes com Parkinsonismo são frequentemente difíceis de gerir em ambulatório. A complexidade de seus sintomas, os déficits cognitivos e autônomos adicionados, a fraca resposta à maioria dos medicamentos de DP, e o declínio relativamente rápido no status contribuem para os desafios na gestão destes pacientes, particularmente à medida que a doença progride (Hohler et al., 2012).