MO para IC
Orbitais Moleculares para o Heterogêneo de Moléculas de Moléculas
Uma abordagem simples para orbitais moleculares (MO), a teoria do heterogêneo de moléculas de moléculas é para mostrar o diagrama de nível de energia. O MO níveis de energia que pode ser trabalhado a seguir estes passos:
Lembrar que a energia \(E_n\) para o número quântico n é um elemento atômico Z é de aproximadamente
\
Nós usamos \(Z_{fep}\) em vez de Z para dizer que temos de modificar o número atômico para obter uma eficaz atômicas de carga para o núcleo. Uma vez que estamos lidando com valores aproximados, pode-se usar Z diretamente. O orbital 1s nível de energia é -13.6 eV para átomos de hidrogênio, medido como a energia de ionização de H.
Assim, para o número quântico n = 1, o nível de energia para 1s de que Ele é um valor de aproximadamente 54 eV. Da mesma forma, o nível de energia 1s para F is – 1101 eV. Os níveis de energia 2s e 2p para ele é aproximadamente – 13,6 eV, que é simlar para o orbital 1s de H.
assim, o nível de energia 2s para Li é aproximadamente -6 eV. No entanto, para os átomos multi-elétrons, a sub-estrutura p e a sub-estrutura s têm energias diferentes devido à penetração. A este nível, não podemos ser precisos sobre ele, mas simplesmente pensar que os orbitais 2p estão em maior energia do que o orbital 2s. Normalmente, orbitais atômicos com níveis de energia semelhantes um ao outro se sobrepõem para formar orbitais moleculares. Assim, nós combinamos os níveis de energia dos orbitais atômicos, e então fazemos ligação e MOs anti-ligação deles.
no entanto, no caso de o nível de energia orbital atômica é muito diferente, usamos orbitais atômicos da subconjunta incompleta para formar MOs.
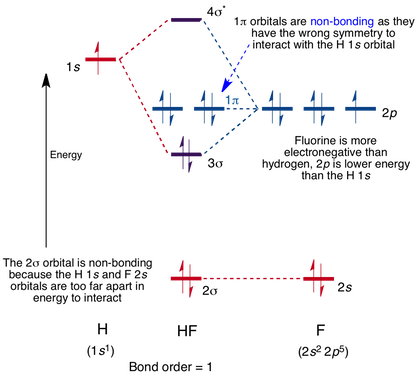
Diagrama de Orbitais Moleculares para a Molécula de HF
a Interação ocorre entre o orbital 1s do hidrogénio, e o orbital 2p em flúor causando a formação de uma sigma-ligação e uma sigma-antibonding de orbitais moleculares, como mostrado abaixo.