o cromato de Potássio
Potássio cromato de Química,Propriedades,Usos, Produção
Inorgânicos compostos
o cromato de Potássio, comumente conhecido como tarapacaite, é uma inorgânico composto, que é amarelo orthorhombic ou hexagonal de cristal em temperatura ambiente. A densidade relativa é 2.732, e o ponto de fusão é 968 °C. é tóxico e pode dissolver em água para formar solução de hidrólise iônica de cromato alcalino. E é insolúvel em álcool e éter. Após adição de ácido, a solução amarela de cromato de potássio torna-se laranja, que é a cor do dicromato. Há um equilíbrio entre a conversão de cromato e dicromato na solução: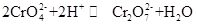
Quando o ácido é adicionado à solução de cromato de potássio, o equilíbrio será mudança na direção da geração de dicromato de potássio, e quando o alcalóide é adicionado para o dicromato de potássio solução, o equilíbrio se deslocará para a direção de gerar o cromato de potássio. O cromato de potássio tem propriedades oxidativas, e pode reagir com o agente redutor em meio alcalino para formar Cr(OH)4-(nomeadamente CrO2-). A adição de diferentes soluções, respectivamente, contendo ião de bário, ião de chumbo e ião de prata à solução de cromato de potássio, formará o correspondente cromato insolúvel: cromato de bário BaCrO4 (amarelo), cromato de chumbo pbCrO4 (amarelo), cromato de prata Ag2CrO4(Vermelho Tijolo). E a presença de iões cromatos pode ser demonstrada pela cor característica destes cromatos insolúveis. Cromato de potássio pode ser usado como reagente analítico, oxidante, mordente, inibidor de ferrugem metálica, e usado para análise de vestígios de bário e prata. Também pode ser usado como matéria-prima da indústria de curtimenta e medicina e outros compostos de crómio. O pó de cromite Fe(CrO2) 2 pode ser utilizado como matéria-prima e calcinado com hidróxido de potássio, calcário (dolomite) no ar, e depois extraído com solução de sulfato de potássio para obter cromato de potássio.
The above information is edited by Xiao Nan of Chemicalbook.
método do indicador o cromato de Potássio
método do indicador o cromato de Potássio, também conhecido como Moore (Mohr), é um método de titulação de precipitação (prata método, que utiliza o cromato de potássio (K2CrO4) como indicador e nitrato de prata (AgNO3) como solução padrão. Este método é utilizado principalmente para a determinação do ião cloro (Cl-) ou ião brometo (Br-). Adicionar uma pequena quantidade de K2CrO4 como indicador antes de indicar a determinação e, em seguida, titular com a solução padrão AgNO3. Após o início da titulação, o precipitado de branco (Cloreto de prata) ou amarelo pálido (brometo de prata) precipita-se primeiro. Quando Cl-ou Br-precipita quantitativamente, um pouco de excesso de solução de nitrato de prata causará a concentração de Ag+ aumentando subitamente para gerar imediatamente a precipitação de cromato de prata vermelho de tijolo (Ag2CrO4), indicando o objectivo de titulação. A quantidade de indicador e a acidez da solução são dois dos principais problemas deste método de titulação. Se o K2CrO4 concentração é muito alta, a cor da titulação da solução vai ser muito profundo para dificultar a observação de Ag2CrO4 precipitação cor no final; se o K2CrO4 concentração é muito baixa, uma excessiva quantidade considerável de solução de nitrato de prata será necessário depois que os quantitativos de precipitação de haleto de prata para gerar o cromato de prata de precipitação para instruir a titulação de ponto final, o que resulta a titulação de erro aumenta. Quando é utilizada a solução de AgNO3 0, 1 mol/l para titular a 0.Haleto de 1mol / l, se a concentração de K2CrO4 for 5× 10-3mol / l, o erro do ponto final é apenas +0,06%, o que pode ser pensado que a precisão do resultado da análise não é afetada. O método indicador K2CrO4 não pode ser realizado em solução ácida ou alcalina, porque o K2CrO4 será convertido em dicromato de potássio (K2Cr2O7) a um pequeno valor de pH, e o Ag+ precipitará na forma de óxido de prata (Ag2O) quando o pH for demasiado elevado. Normalmente, a gama de acidez adequada é pH = 6.5~ 10.5, mas quando há sais de amónio em solução, a acidez da solução pH = 6.5~7.2 é apropriada.
o método indicador de cromato de potássio só pode ser usado para a titulação direta de Cl-ou Br-íons, e o resultado da titulação é o seu total quando coexistem. Este método não é adequado para a determinação do ião iodeto (i-) ou ião tiocianato (SCN-), porque eles são facilmente absorvidos pela sedimentação e o ponto final não é claro. Este método também não é adequado para titulação Ag+ Cl-, mas Ag+ pode ser determinado através de titulação, a saber, adicionar uma quantidade excessiva de solução padrão de NaCl na solução de teste e, em seguida, usar solução padrão de AgNO3 para titular o excesso de Cl-íons. Na solução, todos os catiões que podem formar precipitados com CrO2-4 ou os aniões que podem precipitar com Ag+ interferem com a determinação. O método indicador de cromato de potássio é utilizado principalmente para a determinação dos Cl-iões em solução muito diluída, como a determinação de Cl-em água potável e impurezas de produtos industriais.
dicromato de potássio
dicromato de potássio, também conhecido como Red alum potassium, é um cristal triclínico vermelho-alaranjado ou cristal semelhante a uma agulha. A densidade é de 2,676 g / cm3. A temperatura de fusão é de 398 °C. É solúvel em água e insolúvel em etanol. Tem uma forte propriedade oxidante e decompõe-se a 1300 °C.
em produção, dicromato de potássio é sempre usado para introduzir crómio para fazer o esmalte colorido ao derreter. É o agente de coloração do esmalte amarelo de titânio colorido e do esmalte amarelo de titânio, e a dosagem usada é geralmente de 0,06%~0,12%. Dicromato de potássio e óxido de cobre também podem ser mixados-usados para obter Verde, Verde De Bambu, Verde De Fruta e outros vidros coloridos. No entanto, estes vidros coloridos são geralmente menos brilhantes devido à influência do cromato.
o esmalte de cor obtido da dicromato de óxido de crómio ou potássio (sódio) é frequentemente amarelo-verde devido à mudança de Valência dos iões de crómio no processo de fusão. Dicromato de potássio também é comumente usado para fazer vários pigmentos verdes e pigmentos rosa.
dicromato de potássio deve cumprir os objectivos exigidos: teor de dicromato de potássio ≥ 99%, teor de cloreto (Cl) ≤ 0, 08%, insolúvel em água ≤ 0, 05%.
the above information is compiled by Yaoyao of Chemicalbook. Solubilidade em água (g/100 ml)60 g/10 °C; 63.7 g/20 °C; 66.7 g/30 °C; 67.8 g/40 °C
70.1 g/60 °C; a 74,5 g/90 °C
Toxicidade
Veja cromato de sódio
propriedades Químicas
amarelo Limão orthorhombic de cristal; Solúvel em água; insolúvel em álcool
o Aplicativo
Utilizado como reagente analítico, oxidante, mordente e metal inibidor de ferrugem;usado para a fabricação de cromato,usado como oxidante e mordente de impressão e tingimento. Utilizado para tinta, tinta, esmalte, corrosão metálica,etc., principalmente utilizado no fabrico de reagentes e pigmentos químicos.
preparação
método de neutralização: Dissolver dicromato de potássio no licor-mãe e na água, e depois adicionar a mistura ao reator. Em seguida, adicionar hidróxido de potássio sob agitação para efectuar uma reacção de neutralização. O cromato de potássio produzido é fracamente alcalino, e então evaporado para concentração, resfriado para cristalização, separado e seco para obter os produtos acabados de cromato de potássio.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
o licor-mãe separado será devolvido ao passo dissolvente para dissolver o dicromato de potássio.
propriedades químicas
cristais de amarelo limão
propriedades químicas
cromato de potássio (VI) é um sólido cristalino amarelo.
usa
cromato de potássio (K2CrO4) é solúvel em água e é usado para fazer tintas amarelas brilhantes e pigmentos de tinta. É também usado como reagente em laboratórios químicos e como mordente para”corrigir” corantes em têxteis coloridos.
usa
é usado como um agente oxidante.
Uses
Has a limited application in enamels, finishing course, rustproofing of metals, being replaced by the sodium salt; as reagent in analytical chemistry.
definição
ChEBI: um sal de potássio constituído por iões de potássio e cromatos numa razão de 2:1.
definição
um sal contendo o ionCrO42-.
Definição
o cromato de potássio: Um brilhante yellowcrystalline sólido, K2CrO4, solublein água e insolúvel em álcool;rhombic; r.d. 2.73; m.p. 968.3°C; decompõe-se, sem ferver. É produzido industrialmente por torrefacção de minério de cromite em pó com hidroxicloreto de potássio e calcário e lixiviação da cinzas resultante com solução de sulfato de potássio quente. O potassiumcromato é utilizado na indústria da pasta de couro, como mordente têxtil, inename e pigmentos. In the laboratoryit is used as an analyticalreagent and as an indicator. Tal como outros compostos de crómio(III), é istóxico quando ingerido ou inalado.
Descrição Geral
cromato de potássio é um sólido cristalino amarelo. Cromato de potássio é solúvel em água. O principal perigo é a ameaça ao ambiente. Devem ser tomadas medidas imediatas para limitar a sua propagação ao ambiente. O cromato de potássio é utilizado na análise química, na produção de pigmentos para tintas e tintas, como fungicida, e na produção de outros compostos de crómio.
ar & reacções na água
solúveis em água.
Perfil da Reactividade
agentes Oxidantes, tais como o cromato de Potássio , pode reagir com agentes redutores para gerar calor e produtos que podem ser gasosos (causando pressurização de recipientes fechados). Os próprios produtos podem ser capazes de outras reacções (como a combustão no ar). A redução química dos materiais neste grupo pode ser rápida ou mesmo explosiva, mas muitas vezes requer iniciação (calor, faísca, catalisador, adição de um solvente). As misturas explosivas de agentes oxidantes inorgânicos com agentes redutores persistem, muitas vezes, inalteradas durante longos períodos, caso seja evitada a iniciação. Tais sistemas são tipicamente misturas de sólidos, mas podem envolver qualquer combinação de estados físicos. Alguns agentes oxidantes inorgânicos são sais de metais que são solúveis em água; a dissolução dilui mas não anula o poder oxidante de tais materiais. Compostos orgânicos, em geral, têm algum poder de redução e podem, em princípio, reagir com compostos desta classe. A reatividade real varia muito com a identidade do composto orgânico. Agentes oxidantes inorgânicos podem reagir violentamente com metais ativos, cianetos, ésteres e tiocianatos.
perigo
Tóxico por ingestão e inalação.
risco para a saúde
a inalação causa irritação local das membranas mucosas; a continuação da irritação nasal pode resultar em perfuração do septo nasal. A ingestão pode causar gastroenterite violenta, colapso circulatório, vertigem, coma e nefrite tóxica; a ingestão de quantidades excessivas pode ser fatal. O contacto com os olhos Provoca irritação e conjuntivite graves. A exposição repetida ou prolongada a poeira, névoa ou soluções podem causar dermatite; o contacto com as fracturas na pele pode causar `feridas cromadas” aparecendo como úlceras de cicatrização lenta e endurecida que deixam a área vulnerável a infecções. Comportamento no fogo: pode aumentar a intensidade do fogo se em contacto com materiais combustíveis. Recipientes frescos e material derramado com muita água.
perfil de segurança
carcinogéneo confirmado com dados tumorigénicos experimentais. Por ingestão, via intravenosa, subcutânea e intramuscular. Um experimentalteratogénio. Outros efeitos reprodutivos experimentais. Dados de mutação humana relatados. Um oxidante potente. Quando aquecido àdecomposição, emite fumos tóxicos de K2O. utilizado como mordente para a lã, oxidação e tratamento de corantes em materiais. Ver compostos de alsocromio.
exposição potencial
cromato de potássio é utilizado na impressão: processamento fotomecânico; produção de pigmentos cromados e métodos de conservação de lã; fabrico de corantes, pigmentos, tintas e esmaltes; como agente oxidante; reagente analítico; em galvanoplastia; explosivos.
expedição
UN1479 sólido oxidante, N. A. S., Classe de perigo: 5.1; etiquetas: 5.1-oxidante, nome técnico necessário. UN3288 sólidos Tóxicos, inorgânicos, n.o.s., Classe de risco: 6.1; Etiquetas: 6.1-materiais Venenosos, Nome Técnico Necessário
Métodos de Purificação de
Cristalizar-lo a partir de condutividade da água (0,6 g/mL a 20°), e seque-o entre 135o e 170o.
Incompatibilidades
Um poderoso oxidante. Reações violentas com combustíveis, orgânicos, metais em pó; ou substâncias facilmente oxidáveis. Contacto com hidroxilamina, a hidrazina causa explosão.