ATrain Education
deși învățăm mai multe în fiecare zi despre fiziopatologia bolii Parkinson, este încă considerată în mare parte idiopatică (de cauză necunoscută). Aceasta implică probabil interacțiunea susceptibilității gazdei și a factorilor de mediu. Un procent mic de cazuri sunt legate genetic și factorii genetici sunt intens studiați.
fiziologic, simptomele asociate cu boala Parkinson sunt rezultatul pierderii unui număr de neurotransmițători, în special dopamina. Simptomele se agravează în timp, deoarece tot mai multe celule afectate de boală se pierd. Evoluția bolii este foarte variabilă, unii pacienți prezentând foarte puține simptome pe măsură ce îmbătrânesc și alții ale căror simptome progresează rapid.
Parkinson este văzut din ce în ce mai mult ca o boală neurodegenerativă complexă, cu o secvență de progresie. Există dovezi puternice că afectează mai întâi nucleul motor dorsal al nervului vag și bulbii și nucleul olfactiv, apoi locus coeruleus și, în cele din urmă, substantia nigra. Zonele corticale ale creierului sunt afectate într-o etapă ulterioară. Deteriorarea acestor diferite sisteme neuronale reprezintă modificările patofiziologice cu mai multe fațete care cauzează deficiențe nu doar sistemului motor, ci și sistemelor cognitive și neuropsihologice (Kwan & Whitehill, 2011).
rolul dopaminei
dopamina, ca și alți neurotransmițători, transmite mesaje chimice de la o celulă nervoasă la alta prin sinapsă, un spațiu între celula presinaptică și receptorul postsinaptic. Dopamina este secretată în sinapsă din veziculele de stocare a membranei din membrana presinaptică. Traversează sinapsa și se leagă de membrana postsinaptică, unde activează receptorii dopaminei. Dopamina neutilizată rămasă în sinapsă este absorbită înapoi în celula presinaptică; odată revenit în celula presinaptică, excesul de dopamină este reambalat în vezicule de stocare și eliberat încă o dată în sinapsă.
în sinapsă, pe măsură ce dopamina se deplasează de la o celulă la alta, poate fi descompusă și redată inactivă de două enzime, MAO (monoaminooxidază) și COMT (catecol-O-metil transferază). O strategie terapeutică introduce un inhibitor MAO în sinapsă, care întrerupe acțiunea enzimei MAO și previne descompunerea dopaminei. Acest lucru permite mai multă dopamină să rămână în sinapsă și crește probabilitatea ca aceasta să se lege de membrana postsinaptică.
transmisie sinaptică chimică
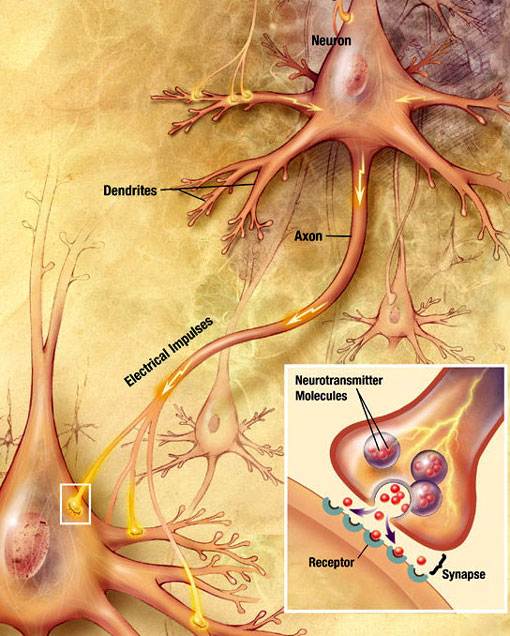
o undă electrochimică numită potențial de acțiune se deplasează de-a lungul axonului unui neuron. Când potențialul de acțiune atinge terminalul presinaptic, provoacă eliberarea unei cantități mici de molecule de neurotransmițător, care se leagă de moleculele receptorilor chimici localizați în membrana neuronului postsinaptic, pe partea opusă a fantei sinaptice. Sursa: Wikimedia Commons.
pierderea progresivă a dopaminei
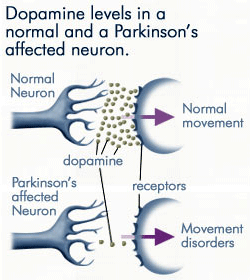
deoarece din ce în ce mai puțină dopamină este produsă de neuronii afectați de boala Parkinson, mult mai puțină dopamină este disponibilă pentru a se lega de receptorii dopaminergici de pe membrana post-sinaptică. Sursa: anti-agingfirewalls.com.
deși pierderea celulelor dopaminei nu poate fi măsurată direct, măsurătorile la persoanele neurologice normale și la primatele neumane relevă o pierdere progresivă lentă a dopaminei odată cu vârsta. În boala Parkinson, pierderea are loc într-un ritm mult mai mare și atât măsurile biochimice, cât și studiile imagistice sugerează că există o scădere semnificativă a dopaminei până la apariția simptomelor motorii. În acest punct de vedere, boala Parkinson este o versiune accelerată a morții celulare observată cu îmbătrânirea normală (Cookson, 2009). Acest lucru este ilustrat în graficul de mai jos, care arată declinul neuronilor dopaminergici în timpul îmbătrânirii normale, în PD idiopatică, în PD cauzată de factori de mediu sau genetici și în PD cu debut precoce.
evoluția epuizării dopaminei în boala Parkinson
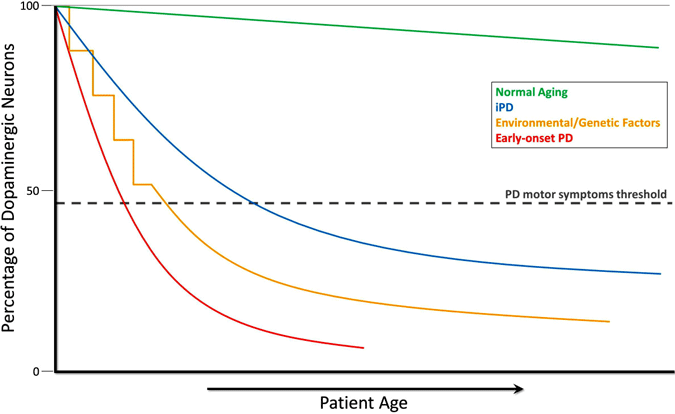
în cursul îmbătrânirii normale (linia verde), degenerarea dopaminergică mică, dar lentă, are loc fără simptome motorii. PD idiopatic (IPD, linia albastră) este de origine necunoscută, dar se crede că se dezvoltă treptat, cu o degenerare lentă a neuronilor dopaminergici care duce la simptomele clasice ale motorului PD mai târziu în viață. Un alt model de neurodegenerare a dopaminei care duce la simptome motorii PD implică expunerea repetată la substanțe toxice de mediu în timp, în combinație cu o predispoziție genetică la pierderea neuronului dopaminergic (linia galbenă). PD cu debut precoce (linia roșie), cauzată de mutații în gena PARKIN, implică o scădere precipitată a neuronilor dopaminergici, iar simptomele motorii PD pot apărea cu zeci de ani înainte de cele din PD idiopatică. Încă un scenariu (nu este prezentat) al dezvoltării simptomelor motorii PD implică posibile toxice de mediu in utero sau factori genetici care duc la un număr atipic scăzut de neuroni dopaminergici la naștere și o susceptibilitate crescută la dezvoltarea PD (Haas și colab., 2012).
degenerarea neuronilor dopaminergici este evidentă în special într-o parte a substanței nigra numită pars compacta. În mod semnificativ, pierderea dopaminei în pars compacta crește unitatea excitatorie generală în ganglionii bazali,* perturbând controlul motor voluntar și provocând simptomele caracteristice ale PD. Normalizarea funcției motorii este observată inițial cu tratamentul cu levodopa (Gasparini și colab., 2013).
*principalele componente ale ganglionilor bazali sunt striatul (nucleul caudat și putamen), globus pallidus, substantia nigra, nucleul accumbens și nucleul subtalamic.
pe măsură ce severitatea PD crește, epuizarea dopaminei duce la modificări suplimentare ale căilor bazale ale ganglionilor, inclusiv funcția modificată a altor neurotransmițători bazali ai ganglionilor, cum ar fi glutamatul, GABA și serotonina (Gasparini și colab., 2013). Deși există o vulnerabilitate relativă a neuronilor producătoare de dopamină în substanța nigra, nu toate celulele dopaminei sunt afectate în boala Parkinson; în unele părți ale creierului, neuronii producătoare de dopamină sunt relativ scutiți (Cookson, 2009).
calea Nigrostriatală
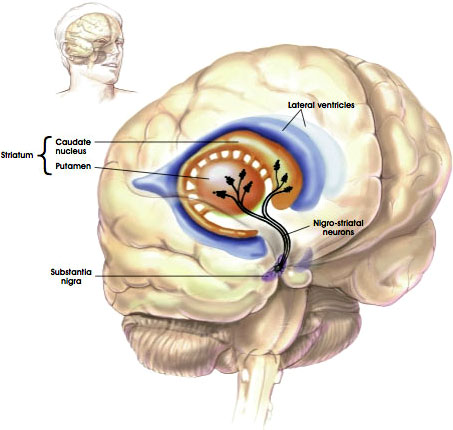
Sursa: NIH, n. d.
corpurile Lewy și alfa-Sinucleina
corpurile Lewy sunt agregate anormale și incluziuni de proteine care se dezvoltă în interiorul celulelor nervoase la persoanele cu boala Parkinson. Agregările constau de obicei din agregate fibrilare insolubile care conțin proteine pliate greșit. Un număr mare de molecule au fost identificate în corpurile Lewy, dar o proteină numită alfa-sinucleină este componenta principală.
corpuri Lewy (incluziuni Alfa-Sinucleine)
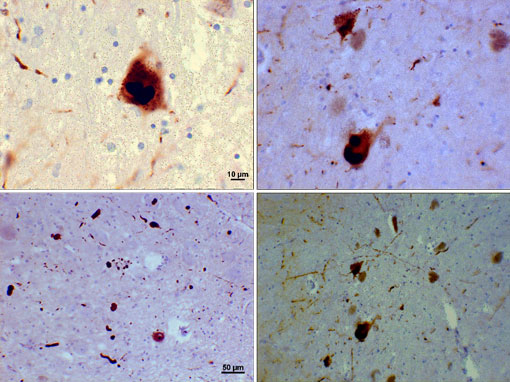
Fotomicrografie a regiunilor substanței nigra la un pacient cu Parkinson care prezintă corpuri Lewy și neurite Lewy în diferite măriri. Panourile de sus arată o mărire de 60x a incluziunilor intraneuronale alfa-sinucleine agregate pentru a forma corpuri Lewy. Panourile de jos sunt imagini de mărire de 20 de centime care prezintă neurite Lewy asemănătoare șuvițelor și corpuri Lewy rotunjite de diferite dimensiuni. Imagini oferite de Suraj Rajan.
patologia Lewy cuprinde multe regiuni ale creierului și unele rapoarte au sugerat că substanța nigra nu este primul loc în care se formează corpurile Lewy în boala Parkinson. Incluziunile și agregatele simbolizează probabil stadiul final al unei cascade de evenimente complicate. O etapă anterioară poate fi legată mai direct de patogeneza tulburării decât incluziunile în sine, care pot reprezenta sau nu semne distinctive de diagnostic.
corpurile Lewy sunt, de asemenea, observate în „demența cu corpurile Lewy”, sugerând că aceste condiții sunt legate între ele prin patologie comună și, eventual, prin etiologie comună. Nici pierderea celulelor, nici formarea corpurilor Lewy nu sunt absolut specifice pentru PD, dar ambele sunt necesare pentru un diagnostic de PD în conformitate cu definițiile actuale (Cookson, 2009).
tulburările Neurodegenerative, cum ar fi boala Alzheimer, degenerarea frontal-temporală, boala prionică, coreea Huntington și bolile motoneuronice, sunt din ce în ce mai mult realizate pentru a avea mecanisme celulare și moleculare comune, inclusiv agregarea proteinelor și formarea corpului de incluziune în anumite zone ale sistemului nervos (Jellinger, 2011).
inflamație și răspuns imun
declanșatorul degenerării dopaminergice pare a fi multifactorial—afectat atât de elementele endogene, cât și de mediu. Inflamația și răspunsurile imune sunt din ce în ce mai mult considerate mediatori importanți ai degenerării dopaminergice. Studiile populaționale mari au sugerat că persoanele care iau medicamente antiinflamatoare nesteroidiene (AINS) au un risc mai mic de a dezvolta PD idiopatică, ceea ce sugerează că medicamentele antiinflamatorii pot fi un tratament promițător de modificare a bolii pentru pacienții parkinsonieni (Barcia, 2013).
noile faze ale studiului au implicat tratamente antiinflamatorii-căutând în mod specific un biomarker obiectiv în tratamentele care vizează reducerea modificărilor inflamatorii la pacienții cu PD. Cercetătorii folosesc instrumente de neuroimagistică pentru a dezvolta un biomarker relevant cu intenția de a testa acest lucru în studiile clinice mari de imagistică. Rezultatul acestor studii va furniza date pentru testarea și monitorizarea progresiei tratamentelor antiinflamatorii pentru PD și va ajuta la identificarea ferestrei terapeutice în timp util pentru a opri sau cel puțin lent, degenerarea dopaminergică mediată inflamator (Barcia, 2013).
Parkinsonismul
Parkinsonismul, cunoscut și sub numele de „Parkinson atipic”, „Parkinson secundar” sau „sindromul Parkinson”, este un sindrom neurologic în care un pacient prezintă unele dintre simptomele asociate cu boala Parkinson—tremor, rigiditate, bradikinezie și instabilitate posturală. Dar parkinsonismul nu este boala Parkinson. Parkinsonismul nu este considerat a fi cauzat de boala Parkinson, iar pacienții răspund de obicei slab la intervenția farmacologică. Parkinsonismul are adesea o cauză identificabilă, cum ar fi expunerea la toxine, metamfetamină, traume, accidente vasculare cerebrale multiple, alte tulburări ale sistemului nervos sau boli. În general, corpurile Lewy nu sunt văzute în parkinsonism.
termenul parkinsonism este, de asemenea, asociat cu tulburări precum paralizia supranucleară progresivă, atrofia sistemului multiplu, demența corpului Lewy, degenerarea corticobazală, parkinsonismul vascular, parkinsonismul indus de medicamente și parkinsonismul secundar infecției și altor cauze (Hohler și colab., 2012). O formă de parkinsonism reversibil poate apărea din utilizarea anumitor medicamente neuroleptice, în special rezerpină, antipsihotice (haloperidol) și metoclopramidă. Expunerea la anumite toxine, intoxicații severe cu monoxid de carbon și intoxicații cu mercur pot duce, de asemenea, la parkinsonism.
apariția la începutul anilor 1980 a simptomelor parkinsonismului într-un grup de dependenți de droguri care consumaseră un lot contaminat dintr-un opiaceu sintetic a dus la descoperirea substanței chimice MPTP ca agent care provoacă sindromul parkinsonismului la primatele neumane, precum și la om. MPTP poate fi produs atunci când se produce o formă de heroină (MPTP este transformat într-o neurotoxină care distruge selectiv celulele dopaminei din substanța nigra). Aceste cazuri sunt rare și au afectat în cea mai mare parte consumatorii de droguri pe termen lung.
abuzul de metamfetamină a fost, de asemenea, legat de parkinsonism. La animalele experimentale, expunerea la metamfetamină dăunează fibrelor dopaminergice din striat*, precum și corpurilor celulare din substanța nigra, ecou al degenerării observate la pacienții umani cu PD. Deteriorarea selectivă a terminalelor dopaminergice din striatum a fost observată și la utilizatorii umani de metamfetamină, deși până în prezent nu există dovezi că abuzul de metamfetamină dăunează corpurilor celulare dopaminergice din substanța nigra (Granado și colab., 2013).
*cel mai mare nucleu al ganglionilor bazali, striatul este format din nucleul caudat și putamenul.
s-a emis ipoteza că utilizarea metamfetaminei poate predispune utilizatorii la dezvoltarea viitoare a PD. Această ipoteză a fost susținută de lucrările epidemiologice recente care indică faptul că utilizatorii de metamfetamină au un risc crescut de a dezvolta PD. Acest lucru este în concordanță cu efectele neurotoxice persistente ale metamfetaminei la animalele experimentale (Granado și colab., 2013).
pacienții cu parkinsonism sunt adesea dificil de gestionat ca pacienți ambulatori. Complexitatea simptomelor lor, deficitele cognitive și autonome adăugate, răspunsul slab la majoritatea medicamentelor PD și scăderea relativ rapidă a statutului contribuie la provocările în gestionarea acestor pacienți, în special pe măsură ce boala progresează (Hohler și colab., 2012).