Bioorganic & Chimie Organică
reacție de Hidroborație–oxidare
adăugarea cis de diboran la o legătură alchenă oferă o metodă extrem de utilă de hidratare. Diboranul poate fi generat prin adăugarea de borohidrură de sodiu la eterat de trifluorură de bor în tetrahidrofuran sau eter la 0o-5oC. Diboranul este dimerul boranului (BH3) și este o formă stabilă a acestui reactiv (Scheme1).
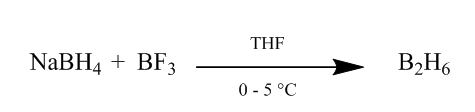
Figura 1 obținerea Diboranului din borohidrura de sodiu
adăugarea de diboran la alchenă este extrem de rapidă și, în general, reactivul se adaugă de la cele mai puțin împiedicate dintre cele două fețe ale sistemului XV. Adăugarea CSI a fost raționalizată de o stare de tranziție de patru centre. Complexul Boran rezultat din adăugarea diboranului la o alchenă este transformat, cu reținerea stereochimiei, într-un alcool prin tratamentul cu peroxid de hidrogen bazic. Astfel, 1-metilciclohexena 1 pe hidroborație-oxidare conduce la formarea trans-2-metilciclo-hexanolului 2. Calea mecanicistă a fost descrisă în (Schema 2). Metoda de conversie a alchenei în alcool prin hidroborare-oxidare a fost aplicată pentru sinteza multor produse naturale. Câteva exemple sunt ilustrate mai jos.

Figura 2 mecanismul de reacție pentru formarea la trans-2-metilciclo-hexanol 2
sinteza junenolului (VIII) și acalomonului (ii)
utilizarea reacției de hidroborație-oxidare a fost observată de către Banerjee și colegii săi în timpul sintezei 3 a sesquiterpenelor eudesmone (ii) junenol și (II) acalomon. Pentru a realiza sinteza acestor sesquiterpene, alchena 3, a fost selectată ca materie primă și supusă hidroborării-oxidării pentru a produce alcoolul 4 (Schema 3). Cetona 5, obținută prin oxidarea alcoolului cu reactivul Jones 4 a fost făcută să reacționeze cu carbonatul de dietil. Produsul rezultat a fost tratat cu metil litiu pentru a obține ketol 6 a cărui conversie în izopropil cetonă 7 a fost efectuată prin deshidratare și, respectiv, hidrogenare. Reducerea hidrurii metalice a cetonei urmată de oxidarea cu tetraacetat de plumb5 în ciclohexan a oferit eterul ciclic 8, care a fost transformat în cetoacid 9 prin oxidare cu acid cromic și acid acetic. Decarboxilarea cu tetraacetat de plumb în benzen și piridină urmată de purificare peste 10% gel de silice impregnat cu AgNO3, acordat acolamonei 10. Reducerea acolamonei 10 cu borohidrură de sodiu în metanol, urmată de sublimarea produsului rezultat a dat junenol 11.
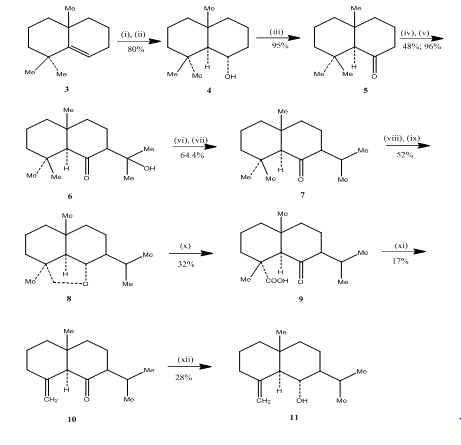
Figura 3 sinteza eudesmonei sesquiterpene (inkt) junenol și (inkt)-acalomon
reactivi: (i) BF3.Et2O, NaBH4, THF, 0-5 int C; (ii) NaOH (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) NaH, CO(OEt)2, DME; (v) MeLi, et2o, reflux, 2h; (vi) HCl(conc), meoh; (vii) H2, pto2, meoh; (viii) na, EtOH, reflux; (ix)Pb(OAc) 4, C6H12; (x) CrO3, AcOH; (xi)Pb(OAc) 4, C6H6, Py, reflux; (xii) NaBH4, EtOH.
sinteza acidului pisiferic
utilizarea hidroborării-oxidării a fost înregistrată în timpul sintezei acidului pisiferic,6 o diterpenă triciclică care prezintă activități antibacteriene împotriva tuturor bacteriilor gram-pozitive testate.7 traseul sintetic a fost descris în Schema 4. Hidroborația-oxidarea alchenei 13, preparată din cunoscutul8 cetoalcool 12, a fost oxidată cu reactivul jones 4 și, respectiv, redusă cu hidrură metalică pentru a da alcool 14. Oxidarea cu tetraacetat de plumb în benzen cu lampă de tungsten 250W a dat eterul ciclic 15. Scindarea eterului ciclic cu zinc, iodură de zinc și acid acetic8 pisiferol mobilat 16. Transformarea pisiferolului în esterul 17 a fost realizată în șase etape:
- metilare cu sulfat de dimetil
- oxidare cu reactiv jones
- esterificare cu diazometan
- reducere cu borohidrură de sodiu
- Tosilare
- Detosilare
esterul L7 a fost transformat în acid pisiferic 18 prin încălzire cu bromură de aluminiu și tiol de etan.
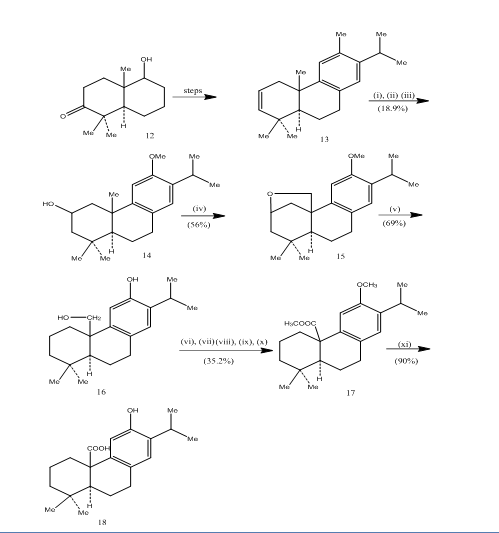
Figura 4 sinteza acidului pisiferic 18
reactivi: (i) BF3.Et2O, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv) Pb(OAc)4, CaCO3, C6H6, lampă de tungsten 250w; (v) Zn, ZnI, MeCOOH; (vi) MeSO4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; (ix) NaBH4, MeOH; (x) TsCl, Py; (xi) NaI, Zn praf, DMF; (xii) AlBr3, (CH2SH)2.
reacția de hidroborație-oxidare a fost aplicată pentru sinteza eudelor (inq) -4(14),7(11)-Dien-8-onă, 9 taxodionă, 10 alcooli norditerpenici11 și multe alte terpene.12 aceste exemple indică în mod clar utilizarea eteratului de tifluorură de bor în conversia alchenelor în alcooli și ulterior transformările lor în compuși terpenoizi.
scindarea epoxizilor
epoxizii pot fi scindați de mai mulți reactivi. Eteratul de Borontrifluorură de acid Lewis a fost, de asemenea, utilizat pentru scindarea epoxizilor și, în multe cazuri, produsul rezultat se rearanjează în cetonă. Scindarea epoxizilor este, de asemenea, însoțită de ciclizare. În această revizuire au fost discutate scindarea unor epoxizi cu eterat de trifluorură de bor și utilizarea produselor rezultate în sinteza produselor naturale.
sinteza 6-metoxi-2-tetralon
s-a utilizat scindarea epoxidului cu eterat de trifluorură de bor 13 pentru sinteza 6-metoxi-2-tetralon 20 (Schema 5), o materie primă importantă selectată pentru sinteza multor compuși organici. Epoxidarea alchenei13 19 urmată de tratarea produsului brut în diclormetan cu eterat de trifluorură de bor a permis tetralonei 20 să obțină un randament de 36%. Când s-a încercat scindarea cu acid sulfuric, randamentul teralonei 20 a fost îmbunătățit (39%) împreună cu formarea altor produse secundare și astfel purificarea cromatografică a fost foarte laborioasă.
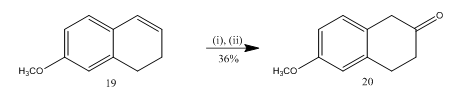
Figura 5 sinteza reactivilor 6-metoxi-2-tetralone 20
: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
sinteza cupranului
rearanjarea epoxizilor cu eterat de trifluorură de bor s-a dovedit foarte utilă în timpul sintezei 14 a cupranului sesquiterpenic. Traseul sintetic este descris în schema 6. 6,6-dimetil-1-p-tolilciclohexena 21 la epoxidare a oferit epoxidului 22 un randament bun care la tratamentul cu trifluorură de bor eterat în benzen a dat aldehida 23 cu randament scăzut. Semicarbazona aldehidei a fost încălzită cu hidroxid de potasiu pentru a furniza cupranul sesquiterpenic 24 în randament acceptabil. Sinteza este atractivă datorită conciziei sale în pași. Condițiile utilizate pentru rearanjarea epoxidului 22 sunt critice, deoarece are tendința de a suferi o rearanjare suplimentară la cetona 25.
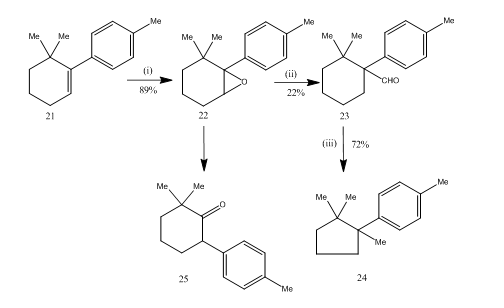
Figura 6 sinteza reactivilor cuprane
: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
sinteza eterului karahana (inqq)
de trifluorură de bor eterat a fost, de asemenea, utilizat pentru scindarea epoxidului în timpul sintezei 15 a eterului karahana, un monoterpen volatil care a fost izolat16 din hameiul Japonez. Traseul sintetic este descris în schema 7. Epoxidul 27, obținut din diena 26, la tratarea cu eter de trifluorură de bor, a fost supus ciclizării, obținându-se Produsul 28. Ciclizarea a avut loc probabil prin intermediarul 27 (i). Reducerea hidrurii metalice a oferit diol care la tosilare a dat karahanaether 29. Randamentul este nespecificat. Scindarea epoxizilor au fost utilizate pentru sinteza multor terpene,cum ar fi rosenolactona,17 cyperolone, 18 maritimol.19
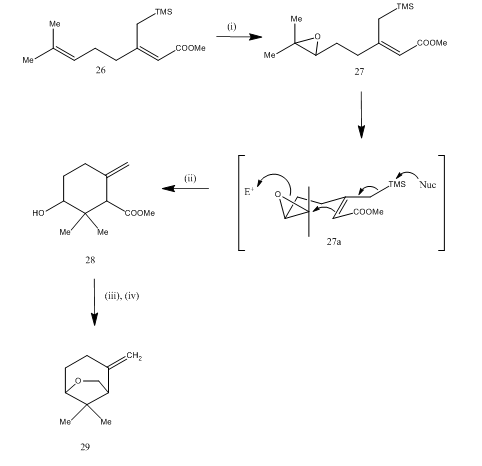
Figura 7 sinteza reactivilor Karahana eter
(i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
esterificarea
esterificarea este o reacție frecvent utilizată pentru sinteza multor compuși organici. Eteratul de trifluorură de bor-alcoolul este un reactiv foarte convenabil pentru esterificarea multor acizi p-amino benzoici, acizi aromatici, heterociclici și nesaturați.20 în unele reacții de esterificare, utilizarea acestui reactiv a oferit un randament superior în comparație cu alți reactivi. Câteva exemple sunt prezentate în schema 8. Acizii 30-32 au fost transformați în esterii 33-35 respectiv cu randament ridicat la tratamentul cu reactiv eterat-alcool trifluorură de bor. Marshall și colaboratori21 au folosit același Reactiv pentru esterificarea acizilor carboxilici. Dymicky22 a preparat mai multe formate cu randament ridicat din acid formic și alcool în prezența unei cantități catalitice de complex trifluorură de bor-metanol. Ceilalți catalizatori, de exemplu acidul sulfuric, acidul sulfonic p – toluen nu a fost atât de eficient ca complexul trifluorură de bor-metanol.
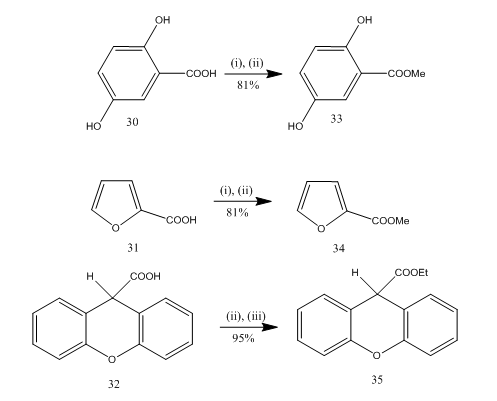
figura 8 esterificarea acizilor 32-35
reactivi: (i) MeOH; (ii) BF3. Et2O; (iii) EtOH
Jackson și colaboratorii23 au dezvoltat o metodă eficientă de conversie a alcoolilor 37-39 și a acizilor 40-42 direct la derivații t-butil corespunzători cu randament bun folosind tricloracetimidatul t-butil 36 în prezența unei cantități catalitice de trifluorură de bor eterat așa cum este prezentat în schema 9. Această metodă funcționează mai bine cu grupurile sensibile la acid decât metodele tradiționale care utilizează izobutenă. Gruparea hidroxil mai puțin împiedicată a unui diol poate fi protejată și, de asemenea, este susceptibilă la lucrări la scară mică (evitând predarea izobutenei gazoase). 2,2,2-tricloracetimidatul de t-butil 36 se prepară ușor prin adăugarea de t-butanol la tricloracetonitril. Majoritatea experimentelor au fost efectuate în prezența unui amestec de diclormetan și ciclohexan. Anhidrida acetică în prezența eteratului de trifluorură de bor a fost utilizată pentru acetilarea grupării hidroxil.24

Figura 9 conversia alcoolilor și acizilor din derivații t-butil.
reactivi: 36, (i) BF3.Et2O, (ii) CH2Cl2, C6H12
ciclizarea
eteratul de trifluorură de bor a jucat un rol important în ciclizarea multor acizi carboxilici, Alene etc. Următoarele câteva exemple vor ilustra rolul eteratului de trifluorură de bor ca agent ciclizant. Clorura acidă 49 și alchena 50 au fost condensate pentru a produce divinil cetone25 51 care a suferit ciclizarea Nazarov26, 27 furnizând cetona ciclică 52 care a fost transformată în sesquiterpenă trichodienă 53 (schema 10).
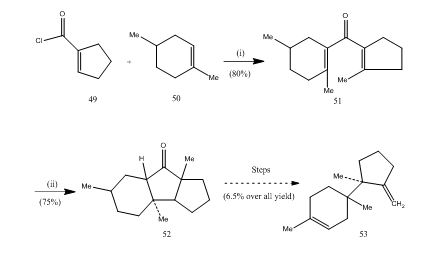
Figura 10 sinteza sesquiterpenei trichodiene 53
reactivi: (i) SnCl4, NaOMe; (ii) BF3Et2O
mai multe cetone de alenil aril suferă ciclizare cu eter de trifluorură de bor, oferind metilen benzociclopentenonă printr-o nouă ciclizare 5-endo-mode.28 cetonele 54-56 au oferit benzociclopentenone 57-59 respectiv (schema 11). Probabil transformarea a avut loc așa cum se arată în ciclizarea alenil aril cetonă 54 în 57. Se poate observa că prezența grupărilor substituente în inelul aromatic determină randamentul produsului ciclizat. Kos și Loewenthal28 au raportat ciclizarea acidului 60 cu trifluorură de bor eterat la cetona 61 care a fost transformată în giberonă 62 (schema 12) în trei etape:
- Ketalizarea
- reducerea Huang-Minlon și hidroliza acidă
- . Exemplele menționate mai sus prezintă utilizarea eteratului de trifluorură de bor în ciclizarea compușilor organici
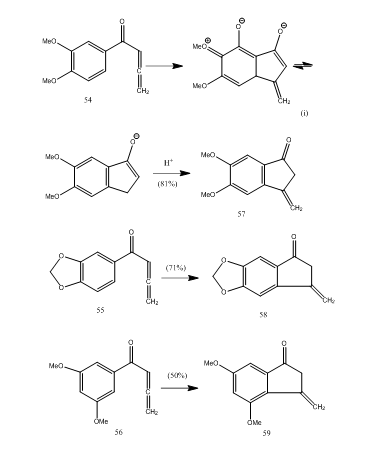
Figura 11 sinteza Ciclopentenonelor

Figura 12 sinteza la giberonă
reactivi: (i) BF3.Et2O; (ii) (a) C2H6O2; (b) DEG, N2H4, KOH, 190-200 C; (C) H+