MO pentru HF
orbitali moleculari pentru molecule diatomice eterogene
o abordare simplă a teoriei orbitale moleculare (mo) pentru molecule diatomice eterogene este de a arăta diagrama nivelului de energie. Nivelurile de energie MO pot fi elaborate urmând acești pași:
reamintim că energia \(E_n\) pentru numărul cuantic n este pentru un element cu atomic Z este aproximativ
\
folosim \(z_{eff}\) în loc de Z pentru a însemna că trebuie să modificăm numărul atomic pentru a obține o sarcină atomică eficientă pentru nucleu. Deoarece avem de-a face cu valori aproximative, se poate folosi Z direct. Nivelul de energie orbitală 1S este de -13,6 eV pentru atomii de hidrogen, măsurat ca energie de ionizare a H.
astfel, pentru numărul cuantic n = 1, Nivelul de energie pentru 1s din He este de aproximativ – 54 eV. În mod similar, nivelul de energie 1s pentru F este – 1101 eV. Nivelurile de energie 2s și 2p pentru el sunt de aproximativ – 13,6 eV, ceea ce este similar cu cel al orbitalului 1s al H.
astfel, nivelul de energie 2s pentru Li este de aproximativ -6 eV. Cu toate acestea, pentru atomii multi-electroni, p-subshell și s-subshell au energii diferite datorită penetrării. La acest nivel, nu putem fi preciși în acest sens, ci pur și simplu credem că orbitalii 2p sunt la o energie mai mare decât orbitalul 2S. De obicei, orbitalii atomici cu niveluri de energie similare între ele se vor suprapune pentru a forma orbitali moleculari. Astfel, potrivim nivelurile de energie ale orbitalilor atomici și apoi facem legătura și anti-lipirea MOs a acestora.
cu toate acestea, în cazul în care nivelul energiei orbitale atomice este foarte diferit, folosim orbitalii atomici ai subshell-ului incomplet pentru a forma MOs.
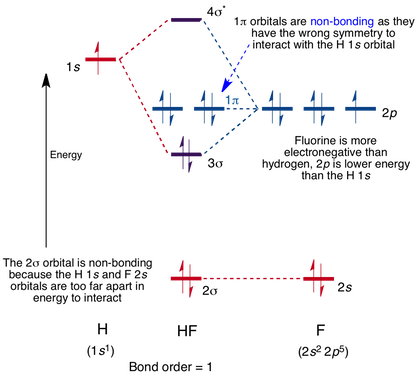
diagrama orbitală moleculară pentru molecula HF
interacțiunea are loc între orbitalul 1s pe hidrogen și orbitalul 2P în fluor determinând formarea unei legături sigma și a unui orbital molecular Sigma-antibonding, așa cum se arată mai jos.