Nu, Oamenii de știință nu vor putea niciodată să îndepărteze spațiul gol din atomii
dacă ar fi să luăm orice obiect din Univers care este făcut din materie normală — orice ființă umană ar putea atinge, vedea sau detecta în alt mod o interacțiune cu utilizarea corpurilor noastre — ai descoperi că l-ai putea despărți în componente din ce în ce mai mici. Un întreg corp uman poate fi împărțit în organe, care la rândul lor sunt alcătuite din celule. Fiecare celulă este formată din organite, care sunt structuri mai mici cu funcții specializate, iar organitele se bazează pe interacțiunile care apar la nivel molecular.
compunând suita completă de molecule sunt atomi: cea mai mică componentă a materiei normale care păstrează caracterul individual și proprietățile elementului în cauză. Elementele sunt definite de numărul de protoni din nucleul fiecărui atom, unde un atom este format din electroni care orbitează acel nucleu. Dar, în ciuda faptului că atomii sunt în mare parte spațiu gol în interior, nu există nicio modalitate de a elimina acel spațiu. Iată povestea de ce.

un atom, la nivelul cel mai de bază, constă dintr-un nucleu atomic încărcat pozitiv, care este extrem de mic în volum. Pentru fiecare proton din nucleul atomic, există un cuantum de sarcină egal și opus care orbitează în jurul său, creând un sistem neutru general: electronul.
cu toate acestea, în timp ce nucleul atomic este limitat la un volum extrem de mic — diametrul unui proton este chiar în jurul valorii de 1 femtometru, sau 10^-15 m — electronii care orbitează, care sunt ei înșiși particule asemănătoare punctului, ocupă un volum care este de aproximativ 1 unct (10^-10 m) în toate cele trei dimensiuni.
primul experiment care a demonstrat această diferență enormă este mai vechi de un secol, când fizicianul Ernest Rutherford a bombardat o foaie subțire de folie de aur cu particule radioactive.
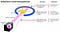
ceea ce a făcut Rutherford a fost simplu și direct. Experimentul a început cu un aparat în formă de inel conceput pentru a detecta particulele care îl întâlnesc din orice direcție. În centrul inelului, folia de aur cu ciocanul subțire a fost plasată de o grosime atât de mică încât nu a putut fi măsurată cu instrumente de la începutul secolului 20: probabil doar câteva sute sau mii de atomi peste.
în afara Inelului și a foliei, a fost plasată o sursă radioactivă, astfel încât să bombardeze folia de aur dintr-o anumită direcție. Se aștepta ca particulele radioactive emise să vadă folia de aur la fel cum un elefant încărcat ar vedea o bucată de hârtie absorbantă: pur și simplu ar trece drept ca și cum folia nu ar fi deloc acolo.
dar acest lucru s-a dovedit a fi adevărat doar pentru majoritatea particulelor radioactive. Câțiva dintre ei — puțini la număr, dar de o importanță vitală-s-au comportat ca și cum ar fi sărit de pe ceva greu și Imobil.

unii dintre ei s-au împrăștiat într-o parte sau alta, în timp ce alții păreau să ricoșeze înapoi spre direcția lor de origine. Acest experiment timpuriu a furnizat prima dovadă că interiorul unui atom nu era o structură solidă așa cum se prevedea anterior, ci mai degrabă consta dintr-un miez extrem de dens, mic și o structură exterioară mult mai difuză. După cum a remarcat Rutherford însuși, privind înapoi decenii mai târziu,
„a fost cel mai incredibil eveniment care mi s-a întâmplat vreodată în viața mea. A fost aproape la fel de incredibil ca și cum ai fi tras cu o carcasă de 15 inci într-o bucată de hârtie absorbantă și s-a întors și te-a lovit.”
acest tip de experiment, în care trageți o particulă cu energie mică, medie sau mare asupra unei particule compozite, este cunoscut sub numele de împrăștiere inelastică profundă și rămâne cea mai bună metodă pentru sondarea structurii interne a oricărui sistem de particule.

pentru atom, de la unul simplu, cum ar fi hidrogenul, la unul complex, cum ar fi aurul, plumbul sau uraniul, electronii pot fi găsiți mult dincolo de întinderea nucleului atomic. În timp ce un nucleu atomic este limitat la un volum care este de aproximativ 1 femtometru cub (10^-15 metri pe fiecare parte), un electron poate fi găsit distribuit probabilistic pe un volum care este de aproximativ un cvadrilion (101 lub) ori mai mare. Această proprietate este independentă de elementul pe care îl considerăm, de numărul de electroni prezenți (atâta timp cât este cel puțin unul) sau de metoda pe care o folosim pentru a măsura electronul sau nucleul.
faptul că atomii sunt în mare parte spațiu gol este cunoscut, astăzi, chiar și pentru majoritatea școlarilor, care învață acest fapt cam în același timp în care învață despre structura atomilor. După ce au învățat acest lucru, mulți dintre ei se întreabă — așa cum sunt sigur că mulți dintre voi se întreabă — de ce nu puteți elimina spațiul gol și atomii compactați la scări mult mai mici, cum ar fi dimensiunea unui nucleu atomic?

în lumea clasică, unde natura joacă după reguli cu care suntem familiarizați și care se potrivesc cu ceea ce prezice intuiția noastră, este foarte ușor să controlăm pozițiile particulelor. Dar la nivel cuantic, există o limitare fundamentală stabilită de regulile naturii: principiul incertitudinii Heisenberg.
chiar dacă știți tot ce este de știut despre un electron care orbitează un nucleu atomic, inclusiv:
- ce nivel de energie ocupă,
- care este starea sa cuantică,
- și câți alți electroni există în nivelurile de energie înconjurătoare,
vor rămâne în continuare o serie de proprietăți care sunt în mod inerent incerte. În special, una dintre proprietățile inerent incerte este poziția electronului; putem doar să trasăm distribuția probabilității unde este probabil să fie electronul.
motivul pentru aceasta este incertitudinea cuantică inerentă dintre poziție și impuls. Impulsul unui electron, la care ne putem gândi ca unitate de mișcare pe care o va avea orice particulă, poate fi cunoscut cu o anumită precizie prin efectuarea unei măsurători specifice.
cu toate acestea, cu cât măsurarea care dezvăluie impulsul este mai precisă, cu atât mai mare este incertitudinea inerentă pe care actul de măsurare îl va da poziției electronului. Dimpotrivă, cu cât încercați mai precis să măsurați poziția electronului, cu atât va fi mai mare incertitudinea pe care o induceți în impulsul electronului. Puteți cunoaște aceste două cantități — poziția și impulsul-cu o precizie limitată în același timp, deoarece măsurarea uneia mai precis va crea o incertitudine inerent mai mare în cea pe care nu o măsurați.

electronul ocupă în mod natural volumul mare pe care l-am așteptat în jurul nucleului atomic din două motive.
- dimensiunea norului de probabilitate pe care îl ocupă electronul depinde de raportul sarcină-masă al electronului. Cu aceeași încărcătură de magnitudine ca protonul, dar doar 1/1836th masa, chiar și forța electromagnetică ultra-puternică nu poate limita electronul la un volum mai mic decât vedem.
- forța exterioară care comprimă un electron în jos pe un nucleu atomic, restricționând componentele exterioare ale norului de probabilitate, este extrem de mică chiar și pentru atomii legați împreună într-o rețea ultra-puternică. Forțele dintre electronii din doi atomi diferiți, chiar și în atomii care sunt legați împreună, sunt foarte mici în comparație cu forța dintre nucleul atomic și un electron.
fiecare dintre aceste motive ne oferă o speranță pentru o soluție care funcționează în practică, dar cu aplicabilitate limitată.

puteți înlocui electronul cu o particulă mai masivă cu aceeași sarcină electrică. Există două particule asemănătoare electronilor care există în modelul Standard cu aceeași sarcină ca electronul: Muonul și tau. Muonul este de aproximativ 200 de ori mai masiv decât un electron și, prin urmare, un atom de hidrogen muonic (cu un proton pentru un nucleu, dar un muon în loc de un electron care îl orbitează) este de aproximativ 200 de ori mai mic decât hidrogenul standard.
dacă legați hidrogenul muonic de un număr de alți atomi, aceștia vor servi drept catalizator pentru fuziunea nucleară, permițându-i să continue cu temperaturi și energii mult mai scăzute decât fuziunea standard. Cu toate acestea, muonii trăiesc doar ~2 microsecunde înainte de a se descompune, iar tau mai masiv trăiește mai puțin de o picosecundă. Acești atomi exotici sunt prea trecători pentru a rămâne utili mult timp.

alternativ, puteți crește presiunea asupra atomilor enorm prin acumularea unor cantități incredibile de masă într-o singură locație din spațiu. Un atom individual izolat ar putea avea o dimensiune de doar un centimetru, dar dacă îngrămădiți Materialul unei stele în jurul său, acel atom va simți o presiune exterioară care „strânge” electronul pentru a ocupa un volum mult mai limitat.
cu cât presiunea este mai mare, cu atât electronii sunt mai limitați și atomii sunt mai mici în ceea ce privește întinderea fizică. Există o limită a presiunii exterioare pe care atomii o pot suporta înainte de aceeași catastrofă ca cea anterioară: nucleele atomice se apropie atât de mult încât funcțiile lor de undă se suprapun și fuziunea nucleară poate avea loc. La o pitică albă, acest prag are loc la aproximativ 1,4 mase solare; depășește-l și vei ajunge să inițiezi o reacție de fuziune fugară, care are ca rezultat în acest caz o supernovă de tip Ia.

ar putea fi un vis încântător de science fiction pentru a elimina spațiul gol din atomi, scăzând volumul pe care materia îl ocupă de factori de milioane, trilioane sau chiar mai mult. Cu toate acestea, nu este faptul că electronii care orbitează nucleul ocupă în mod inerent un volum extrem de mare de spațiu, ci mai degrabă că proprietățile cuantice inerente particulelor — mase, SARCINI, puterea de interacțiune și incertitudinea cuantică — toate se combină pentru a crea atomii care există în universul nostru.
chiar dacă am avea o contrapartidă stabilă și mai grea a electronului sau capacitatea de a comprima materia în stări arbitrare dense, am intra într-un prag cuantic în care nucleele atomice din centrele atomilor s-ar fuziona spontan, împiedicând configurații stabile ale mai multor atomi să existe deloc. Faptul că atomii noștri sunt în mare parte spațiu gol permite existența moleculelor, chimiei și vieții.
eliminarea spațiului gol din atomi ar putea fi un experiment de gândire distractiv, dar atomii au dimensiunea pe care o au datorită regulilor Universului. Existența noastră depinde de faptul că spațiul gol este prezent, dar constantele naturii având valorile pe care le au, nu vă faceți griji. Nu poate fi altfel.