Structura moleculară dezvăluie modul în care funcționează antibioticul streptomicină | BNL Newsroom
structura moleculară dezvăluie modul în care funcționează antibioticul streptomicină
5 septembrie 2013
streptomicina a fost primul antibiotic dezvoltat pentru a trata tuberculoza încă până de curând, oamenii de știință nu au înțeles complet cum funcționează la nivel molecular. Ei știau că streptomicina blochează un proces critic, sinteza proteinelor de către ribozomi ducând la moartea celulelor bacteriene, dar anumite detalii ale interacțiunii au rămas nedescoperite. La sursa Națională de lumină Synchrotron a Laboratorului Național Brookhaven, cercetătorii au folosit cristalografia cu raze X pentru a completa imaginea.
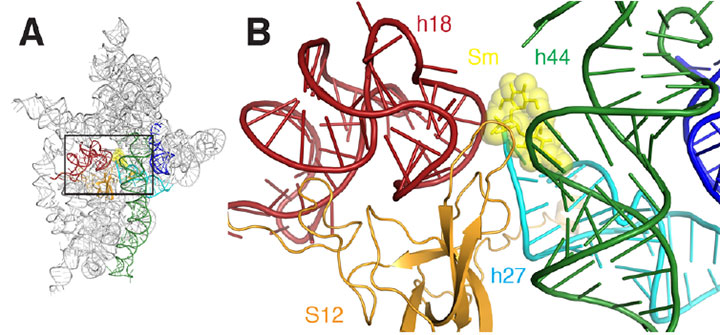
A) o diagramă panglică a situsului de legare a streptomicinei ribozomului. B) un prim-plan al zonei dreptunghiulare conturate în A. streptomicina este reprezentată ca sHcks și sfere galbene, helicele sunt colorate în roșu, verde închis, cyan, portocaliu și albastru.
streptomicina este un membru al unei familii de antibiotice care acționează prin întreruperea funcției ribozomilor celulelor bacteriene, mașinile moleculare complexe care creează proteine prin legarea aminoacizilor împreună. Ribozomii, o țintă majoră pentru antibioticele care funcționează prin inhibarea sintezei proteinelor, au două părți principale sau „subunități”.”
subunitatea mai mare face construirea proteinelor, ghidată de un tip de ARN numit ARN mesager (ARNm), care se leagă de acesta. Subunitatea mică „citește” ARNm și selectează molecula de ARN de transfer (Tarn) potrivită, care selectează și livrează următorul aminoacid către ribozom. Aici streptomicina joacă un rol. Se leagă aproape de subunitatea mică, determinând-o să interpreteze grav secvența. Acest lucru are ca rezultat sinteza proteinelor aleatorii, care în cele din urmă ucide bacteriile. Dar modul în care a avut loc această interpretare greșită a rămas un mister, până la un studiu recent realizat de cercetători de la Universitatea Brown și echipa multi-instituție Northeastern Collaborative Access de la Argonne National Laboratory (administrată de Universitatea Cornell).
prin crearea unui cristal – o structură ordonată de unități identice – a subunității ribozomale mici legate de ARNm în prezența streptomicinei, cercetătorii au generat mai multe „instantanee” detaliate care au dezvăluit detalii cheie la nivel molecular ale interacțiunii, arătând în cele din urmă modul în care streptomicina afectează funcția subunității. La NSLS beamline X25, au folosit o tehnică numită cristalografie cu raze X, în care un fascicul de raze X vizează cristalul, interacționează cu moleculele și produce un model complicat de difracție. Din model, cu ajutorul software-ului de calculator, grupul a construit reprezentări vizuale ale complexului subunitar-ARNm-streptomicină.
pe scurt, cercetătorii au putut „vedea” pentru prima dată modalitățile subtile în care streptomicina distorsionează structura site-ului de decodare al subunității, determinând-o să citească incorect ARNm. De exemplu, legarea streptomicinei reduce distanța dintre două dintre numeroasele helice care alcătuiesc structura moleculară a subunității. Acest lucru este deosebit de important deoarece aceste helice formează site-ul real de decodare, iar decodarea are loc corect numai dacă aceste elemente sunt orientate exact corect în ceea ce privește ARNm și Arnt selectat. Legarea streptomicinei induce, de asemenea, o schimbare în relația dintre una dintre aceste două helice și o a treia helix, determinând una să se retragă de cealaltă sau „să se deconecteze”.”
rezultatul final al tuturor acestor modificări ușoare este că streptomicina destabilizează legarea între subunitate și Arnt „corect”, stabilizând simultan legarea subunității la Arnt „greșit”, eliminând astfel în mod eficient discriminarea dintre Arnt corect și cel greșit. Acest lucru provoacă ravagii în lanțul de aprovizionare bacteriană pentru noi proteine, perturbând reproducerea bacteriilor și ciclul de viață.
„studiile noastre structurale au arătat că streptomicina induce distorsiuni surprinzător de mari în ribozomul bacterian, care ne ajută să înțelegem cum acest antibiotic interferează cu sinteza proteinelor în bacterii”, a declarat cercetătorul principal Gerwald Jogl, profesor asociat de biologie în biologia moleculară a lui Brown, Biologie Celulară & Departamentul de Biochimie. „Continuând din descoperirile noastre actuale, studiem acum modul în care mutațiile ribozomilor bacterieni pot contracara aceste rearanjări structurale și permit bacteriilor să supraviețuiască acțiunii altfel letale a streptomicinei.”
această cercetare a fost publicată în ediția din 15 ianuarie 2013 a Nature Communications, sub titlul „o bază structurală pentru interpretarea greșită indusă de streptomicină a codului genetic.”Sprijinul a venit din partea Institutelor Naționale de sănătate și a Departamentului Energiei.
2013-4251 | int / EXT / Newsroom