bioorganisk och organisk kemi
hydroboration–oxidationsreaktion
cis-tillsatsen av diboran till en alkenbindning ger en extremt användbar hydreringsmetod. Diboran kan genereras genom tillsats av natriumborhydrid till bortrifluorideter i tetrahydrofuran eller eter vid 0o-5oC. Diboran är dimeren av Boran (BH3) och är stabil form av detta reagens (Scheme1).
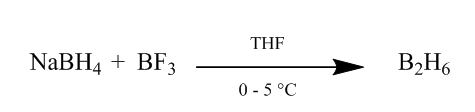
Figur 1 Obtention av Diboran från natriumborhydrid
tillsatsen av diboran till alkenen är extremt snabb och i allmänhet tillför reagenset från de mindre hindrade av de två ytorna i 2-systemet. Cis-tillägget har rationaliserats av ett övergångstillstånd med fyra centrum. Borankomplexet som härrör från tillsatsen av diboran till en alken omvandlas, med retention av stereokemi, till en alkohol genom behandling med basisk väteperoxid. Således leder 1-metylcyklohexen 1 på hydroborationsoxidation bildandet av trans-2-metylcyklo-hexanol 2. Den mekanistiska vägen har avbildats i (Schema 2). Metoden för omvandling av Alken till alkohol genom hydroborationsoxidation har tillämpats för syntes av många naturliga produkter. Några exempel illustreras nedan.

Figur 2 reaktionsmekanism för bildning till trans-2-metylcyklo-hexanol 2
syntes av (ig) junenol och (ig) acalomon
användningen av hydroboration-oxidationsreaktion observerades av Banerjee och medarbetare under syntesen3 av eudesmone sesquiterpener (ig) junenol och (ig) acalomon. För att uppnå syntesen av dessa sesquiterpener alkenen 3, valdes som utgångsmaterial och utsattes för hydroboration-oxidation för att ge alkoholen 4 (schema 3). Keton 5, erhållen genom oxidation av alkoholen med Jones-reagens4 gjordes för att reagera med dietylkarbonat. Den resulterande produkten behandlades med metyllitium för att erhålla ketol 6 vars omvandling till isopropylketon 7 utfördes genom dehydrering respektive hydrogenering. Metallhydridreduktion av ketonen följt av oxidation med blytetraacetat5 i cyklohexan gav den cykliska etern 8, som omvandlades till ketosyra 9 genom oxidation med kromsyra och ättiksyra. Dekarboxylering med blytetraacetat i bensen och pyridin följt av rening över 10% AgNO3-impregnerad silikagel som ges (POV) acolamon 10. Reduktion av acolamon 10 med natriumborhydrid i metanol, följt av sublimering av den resulterande produkten gav junenol 11.
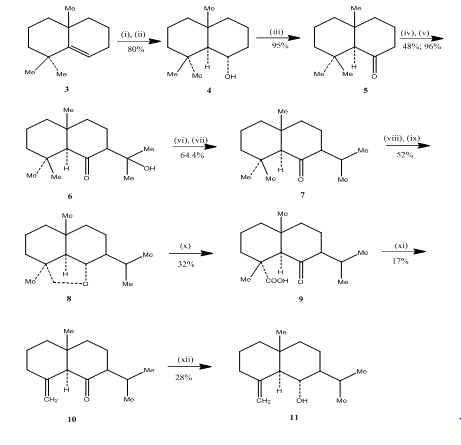
Figur 3 syntes av eudesmone sesquiterpener (kubi) junenol och (kubi)-acalomon
reagens: (i) BF3.Et2O, NaBH4, THF, 0-5 C; (ii) NaOH (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) NaH, CO(OEt)2, DME; (v) MeLi, Et2O, reflux, 2h; (vi) HCl(Conc), meoh; VII) H2, pto2, meoh; viii) Na, EtOH, reflux; ix) Pb (OAc)4, C6H12; x) CrO3, AcOH; xi) Pb (OAC)4, C6H6, Py, reflux; xii) NaBH4, EtOH.
syntes av pisiferinsyra
användningen av hydroborationsoxidation har registrerats under syntesen av pisiferinsyra,6 en tricyklisk diterpen som visar antibakteriella aktiviteter mot alla testade grampositiva bakterier.7 den syntetiska vägen har avbildats i Schema 4. Hydroboration-oxidation av alkenen 13, framställd från den kända8 ketoalkohol 12, oxiderades med jones-reagens4 och reducerades respektive med metallhydrid för att ge alkohol 14. Oxidation med blytetraacetat i bensen med 250W volframlampa gav den cykliska etern 15. Klyvningen av den cykliska etern med zink, zinkjodid och ättiksyra8 möblerad pisiferol 16. Omvandlingen av pisiferol till ester 17 uppnåddes i sex steg:
- metylering med dimetylsulfat
- Oxidation med jones-reagens
- förestring med diazometan
- reduktion med natriumborhydrid
- Tosylering
- Detosylering
estern L7 omvandlades till pisiferinsyra 18 genom upphettning med aluminiumbromid och etan tiol.
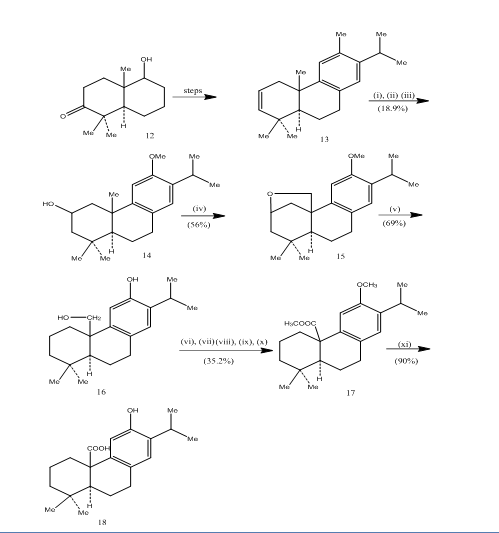
Figur 4 syntes av Pisiferinsyra 18
reagens: (i) BF3.Et2O, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv) Pb(OAc)4, CaCO3, C6H6, 250W volframlampa; (v) Zn, ZnI, MeCOOH; vi) MeSO4, Me2CO; vii) H2SO4-HCrO4; viii) CH2N2, Et2O; ix) NaBH4, MeOH; x) TsCl, Py; xi) NaI, Zn dust, DMF; xii) AlBr3, (CH2SH)2.
hydroborationsoxidationsreaktionen har applicerats för syntes av (exporteras) eudes-4(14),7(11)-Dien-8-on, 9 taxodion, 10 norditerpenalkoholer11 och många andra terpener.12 Dessa exempel indikerar tydligt användningen av bor-tifluorideter vid omvandlingen av alkenerna till alkoholer och därefter deras omvandlingar till terpenoidföreningarna.
klyvning av epoxider
epoxiderna kan klyvas av flera reagenser. Lewis-syraborontrifluorideteratet har också använts för klyvning av epoxider och i många fall omarrangeras den resulterande produkten till keton. Klyvningen av epoxider åtföljs också av cyklisering. I denna översyn har klyvningen av vissa epoxider med bortrifluorideter och användningen av de resulterande produkterna i syntesen av naturliga produkter diskuterats.
syntes av 6-metoxi-2-tetralon
klyvningen av epoxid med bortrifluorideter har utnyttjats13 för syntes av 6-metoxi-2-tetralon 20 (schema 5), ett viktigt utvalt utgångsmaterial för syntes av många organiska föreningar. Epoxidering av alkenen13 19 följt av behandling av råprodukten i diklormetan med bortrifluorideterat gav tetralonen 20 i 36% utbyte. När klyvningen provades med svavelsyra förbättrades utbytet av teralen 20 (39%) tillsammans med bildandet av andra sekundära produkter och därmed var den kromatografiska reningen mycket mödosam.
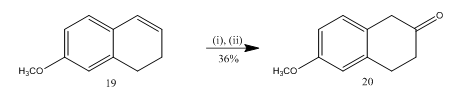
Figur 5 syntes av 6-metoxi-2-tetralon 20
reagens: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
syntes av cuprane
omarrangemanget av epoxider med bortrifluorideterat visade sig vara mycket användbart under syntesen14 av sesquiterpen cuprane. Den syntetiska vägen beskrivs i Schema 6. 6,6-dimetyl-1-p-tolylcyklohexen 21 på epoxidation gav epoxiden 22 i gott utbyte som vid behandling med bortrifluorideter i bensen gav aldehyden 23 i lågt utbyte. Halvkarbazonen av aldehyden upphettades med kaliumhydroxid för att förse sesquiterpen cuprane 24 i acceptabelt utbyte. Syntesen är attraktiv på grund av dess korthet i steg. Villkoren som används för omläggning av epoxiden 22 är kritiska eftersom den har en tendens att genomgå ytterligare omläggning till ketonen 25.
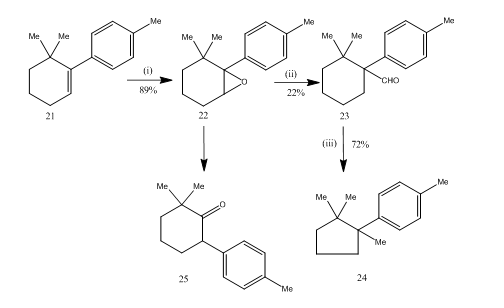
Figur 6 syntes av cuprane
reagens: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
syntes av karahana-eter
Bortrifluorideterat användes också för klyvning av epoxid under syntesen15 av karahana-eter, en flyktig monoterpen som isolerades 16 från japanska humle. Den syntetiska vägen beskrivs i Schema 7. Epoxiden 27, erhållen från Dien 26, vid behandling med bortrifluorideterat genomgick cyklisering vilket gav produkten 28. Cykliseringen inträffade troligen genom mellanliggande 27 (i). Metallhydridreduktion gav diol som på tosylering gav karahanaether 29. Avkastningen är ospecificerad. Klyvningen av epoxider har använts för syntes av många terpener som rosenolakton,17 cyperolon,18 maritimol.19
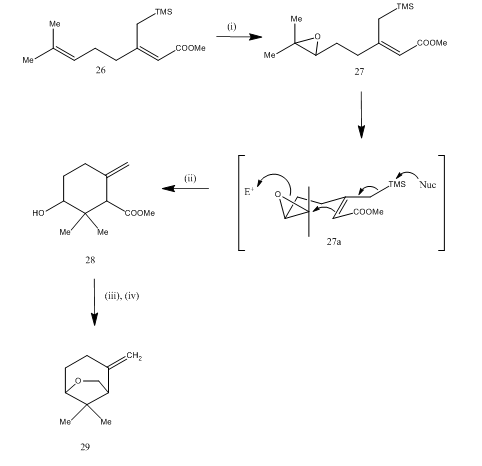
figurera 7 syntes av (masturbation) Karahana eter
reagenser: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
förestring
förestring är en ofta använd reaktion för syntes av många organiska föreningar. Bortrifluorideter-alkohol är ett mycket bekvämt reagens för förestring av många p-aminobensoesyror, aromatiska, heterocykliska och omättade syror.20 i vissa förestringsreaktioner gav användningen av detta reagens överlägsen avkastning jämfört med andra reagens. Några exempel ges i Schema 8. Syrorna 30-32 omvandlades till estrarna 33-35 respektive i högt utbyte vid behandling med bortrifluorid eteratalkoholreagens. Marshall och kollaboratörer21 använde samma reagens för förestring av karboxylsyror. Dymicky22 framställde flera format i högt utbyte från myrsyra och alkohol i närvaro av en katalytisk mängd bortrifluorid-metanolkomplex. De andra katalysatorerna t.ex. svavelsyra, p-toluensulfonsyra var inte så effektiv som bortrifluorid – metanolkomplex.
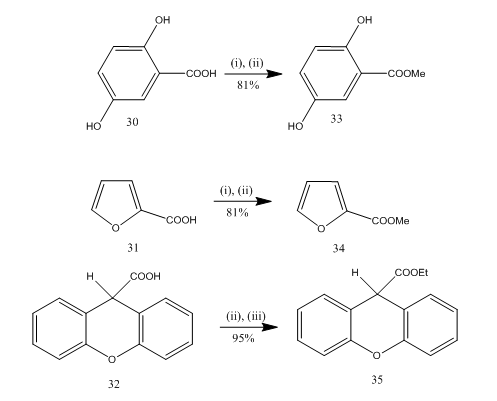
figur 8 förestring av syror 32-35
reagens: (i) MeOH; (ii) BF3. Et2O; iii) EtOH
Jackson och medarbetare 23 har utvecklat en effektiv metod för omvandling av alkoholer 37-39 och syror 40-42 direkt till motsvarande t-butylderivat i gott utbyte med användning av T-butyltrikloracetimidat 36 i närvaro av en katalytisk mängd bortrifluorideter som visas i Schema 9. Denna metod fungerar bättre med de syrakänsliga grupperna än de traditionella metoderna som använder isobuten. Mindre hindrad hydroxylgrupp av en diol kan skyddas och är också mottaglig för småskaligt arbete (undviker överlämnande av gasformig isobuten). T-butyl-2,2,2-trikloracetimidat 36 bereds lätt genom tillsats av T-butanol till trikloracetonitril. De flesta experimenten utfördes i närvaro av en blandning av diklormetan och cyklohexan. Ättiksyraanhydrid i närvaro av bortrifluorideter har använts för acetylering av hydroxylgrupp.24

Figur 9 omvandling av alkoholer och syror från t-butylderivat.
reagenser: 36, (i) BF3.Et2O, (ii) CH2Cl2, C6H12
cyklisering
bortrifluorideteratet har spelat en viktig roll vid cyklisering av många, karboxylsyror, allener etc. Följande Få exempel illustrerar rollen av bortrifluorideterat som cykliseringsmedel. Syrakloriden 49 och Alken 50 kondenserades för att ge divinylketone25 51 som genomgick Nazarov-cyklisering26,27 som gav cyklisk keton 52 som omvandlades till sesquiterpen-trikodien 53 (schema 10).
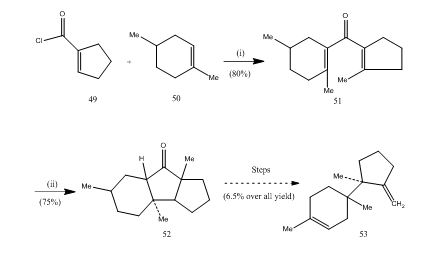
Figur 10 syntes av Sesquiterpentrikodien 53
reagens: (i) SnCl4, NaOMe; (ii) BF3Et2O
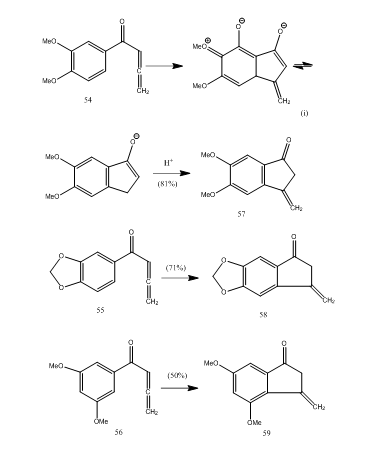
flera allenyl-arylketoner genomgår cyklisering med bortrifluorideterat som ger metylenbensocyklopentenon via en ny 5-endo-mode-cyklisering.28 ketonerna 54-56 gav bensocyklopentenoner 57-59 respektive (schema 11). Förmodligen inträffade omvandlingen som visas i cykliseringen av allenyl-arylketon 54 till 57. Det kan observeras att närvaron av substituentgrupper i aromatisk ring bestämmer utbytet av den cykliserade produkten. Kos och Loewenthal28 rapporterade cykliseringen av syran 60 med bortrifluorideter till ketonen 61 som omvandlades gibberone 62 (schema 12) i tre steg:
- Ketalisering
- Huang-Minlon reduktion och
- Syrahydrolys. Ovanstående exempel uppvisar användningen av bortrifluorideter i cykliseringen av organiska föreningar
Figur 11 syntes av Cyklopentenoner

Figur 12 syntes till Gibberone
reagens: (i) BF3. Et2O; (ii) (a) C2H6O2; (b) DEG, N2H4, KOH, 190-200 CB; (c) H+