elektroner i skalen
![]()
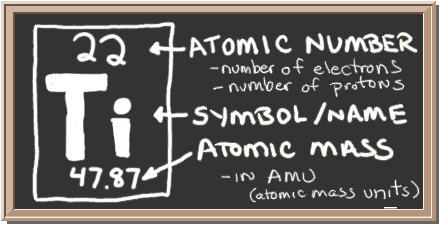
kolla in tavlan. Den rutan till vänster har all information du behöver veta om ett element. Det berättar massan av en atom, hur många bitar är inuti, och var den ska placeras på det periodiska bordet.
nu arbetar vi med den fjärde perioden/raden i elementtabellen. Du kan ha ett enkelt sätt att veta antalet elektroner i en neutral atom, men placeringen av dessa elektroner blir lite mer komplex. Låt oss ta en titt på arrangemanget av elektroner i grundelementen (vänster och höger sida av bordet) i period fyra och de mer komplexa arrangemangen för övergångselementen (i mitten av raden). Om du tycker att det här är lite över huvudet, gå tillbaka och titta på elementen 1-18 som har organisationer som är lite enklare.
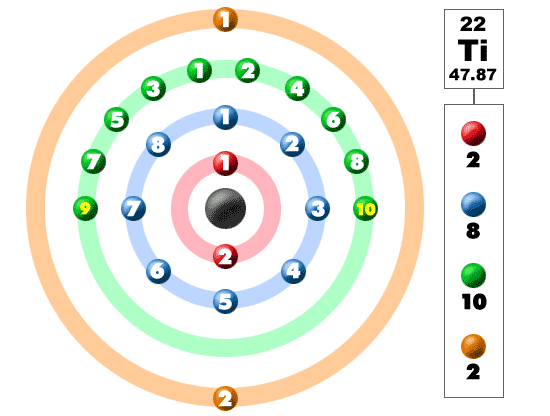
ta en titt på bilden nedan. Var och en av dessa färgade bollar är en elektron. I en atom snurrar elektronerna runt mitten, även kallad kärnan. Elektronerna gillar att vara i separata skal/orbitaler. När du lär dig mer om atomstruktur kommer du att lära dig att elektronerna inte stannar i definierade områden runt kärnan. De finns i moln som kan ha olika former som inkluderar sfärer och hantelliknande former. Så kom ihåg när du tittar på vår uppdelning att elektronerna inte alltid är i en fin snygg ordning som visas här.
detta element är ett av övergångselementen som inte placerar de extra elektronerna i det yttre skalet, utan i det under. För den fjärde perioden / raden bygger alla dessa elektroner det tredje skalet till maximalt 18 elektroner. Kom ihåg att de första åtta placerades under vår resa genom den tredje perioden/raden. Den fjärde raden i det periodiska bordet har övergångsmetaller som sträcker sig från skandium (21) till Zink (30).
Titan är en metall. Det är inte bara någon metall, det är en övergångsmetall. Att vara en övergångsmetall har en speciell elektronkonfiguration. Det lägger till sin nästa elektron till det tredje skalet, inte det yttersta fjärde skalet. Med en konfiguration av 2-8-10-2 är Titan ute i världen och redo att binda med andra element. Det gör många naturliga föreningar med halogener och syre. Eftersom Titan finns där ute med fyra extra elektroner är det ganska flexibelt och bildar många föreningar.