kaliumkromat
kaliumkromat kemiska egenskaper, användningsområden, produktion
oorganisk förening
kaliumkromat, allmänt känd som tarapacaite, är en oorganisk förening, som är gul ortorombisk eller hexagonal kristall vid rumstemperatur. Den relativa densiteten är 2.732, och smältpunkten är 968 C. Det är giftigt och kan lösas i vatten för att bilda alkalisk kromatjonhydrolyslösning. Och det är olösligt i alkohol och eter. Efter tillsatt syra blir den gula lösningen av kaliumkromat orange, vilket är färgen på dikromat. Det finns en jämvikt mellan omvandlingen av kromat och dikromat i lösningen: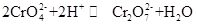
när syran tillsätts till kaliumkromatlösningen kommer jämvikten att skiftas mot riktningen för att generera kaliumdikromat, och när alkalin tillsätts till kaliumdikromatlösningen kommer jämvikten att skiftas till riktningen för att generera kaliumkromat. Kaliumkromat har oxidativa egenskaper, och det kan reagera med reduktionsmedlet i alkaliskt medium för att bilda Cr(OH)4-(nämligen CrO2-). Att tillsätta olika lösningar innehållande bariumjon, blyjon och silverjon till kaliumkromatlösningen bildar motsvarande olösliga kromat: bariumkromat BaCrO4 (gul), blykromat pbCrO4(gul), silverkromat Ag2CrO4 (tegelröd). Och närvaron av kromatjoner kan demonstreras av den karakteristiska färgen hos dessa olösliga kromater. Kaliumkromat kan användas som analytiskt reagens, oxidant, mordant, metallrostinhibitor och används för barium-och silverspåranalys. Det kan också användas som råmaterial för garvning och medicinindustrin och andra kromföreningar. Kromit Fe (CrO2)2-pulver kan användas som råmaterial och kalcineras med kaliumhydroxid, kalksten (dolomit) i luften och extraheras sedan med kaliumsulfatlösning för att erhålla kaliumkromat.
ovanstående information redigeras av Xiao Nan från Chemicalbook.
Kaliumkromatindikatormetod
Kaliumkromatindikatormetod, även känd som Moore (Mohr), är en utfällningstitreringsmetod (silvermetod) som använder kaliumkromat (K2CrO4) som Indikator och silvernitrat (AgNO3) som standardlösning. Denna metod används huvudsakligen för bestämning av klorjon (Cl-) eller bromidjon (Br-). Tillsätt en liten mängd K2CrO4 som indikator innan bestämning anges och titrera sedan med AgNO3 standardlösning. Efter titreringens början utfälls fällningen av vit (silverklorid) eller blekgul (silverbromid) först. När Cl – eller Br-fälls ut kvantitativt, kommer ett litet överskott av silvernitratlösning att orsaka att koncentrationen av Ag + plötsligt ökar för att omedelbart generera tegelröd silverkromat (Ag2CrO4) nederbörd, vilket indikerar titreringsändpunkten. Mängden Indikator och lösningens surhet är två stora problem med denna titreringsmetod. Om K2CrO4-koncentrationen är för hög kommer titreringslösningens färg att vara för djup för att hindra observationen av Ag2CrO4-utfällningsfärgen i slutet; om K2CrO4-koncentrationen är för låg kommer en alltför stor mängd silvernitratlösning att behövas efter den kvantitativa utfällningen av silverhalogenid för att generera silverkromatutfällning för att instruera titreringsändpunkten, vilket resulterar i att titreringsfelet ökar. När 0,1 mol/l AgNO3-lösningen används för att titrera 0.1mol / l Halid, om koncentrationen av K2CrO4 är 5 10-3 mol / L, är slutpunktsfelet endast +0,06%, vilket kan antas att analysresultatets noggrannhet inte påverkas. K2CrO4-indikatormetoden kan inte utföras i sur eller alkalisk lösning, eftersom K2CrO4 omvandlas till kaliumdikromat (K2Cr2O7) vid ett litet pH-värde och Ag+ fälls ut i form av silveroxid (Ag2O) när pH är för högt. Vanligtvis är det lämpliga surhetsområdet pH = 6,5~ 10,5, men när det finns ammoniumsalter i lösning är lösningens surhet pH = 6,5~7,2 lämpligt.
kaliumkromatindikatormetoden kan endast användas för direkt titrering av Cl-eller Br-joner, och titreringsresultatet är deras totala när de samexisterar. Denna metod är inte lämplig för bestämning av jodidjon (i-) eller tiocyanatjon (SCN-), eftersom de absorberas för lätt genom sedimentering och slutpunkten är oklar. Denna metod är inte heller lämplig för titrering av Ag+ med Cl-, men Ag+ kan bestämmas med hjälp av baktitreringen, nämligen tillsätt en överdriven mängd NaCl-standardlösning i testlösningen och använd sedan AgNO3-standardlösning för att titrera överskott av Cl-joner. I lösningen kommer alla katjoner som kan bilda fällningar med CrO2-4 eller anjonerna som kan fälla ut med Ag+ att störa bestämningen. Kaliumkromatindikatormetod används huvudsakligen för bestämning av Cl-jonerna i mycket utspädd lösning, såsom bestämning av Cl-i dricksvatten och industriprodukter föroreningar.
kaliumdikromat
kaliumdikromat, även känt som röd alun kalium, är orangefärgad triklinisk kristall eller nålliknande kristall. Densiteten är 2,676 g/cm3. Smälttemperaturen är 398 kcal C. Det är lösligt i vatten och olösligt i etanol. Den har en stark oxiderande egenskap och sönderdelas vid 1300 kcal C.
i produktion används kaliumdikromat alltid för att införa krom för att göra emaljen färgad vid smältning. Det är färgämnet för färgad Titan mjölk gul glasyr och Titan gul glasyr, och den använda dosen är i allmänhet 0,06%~0,12%. Kaliumdikromat och kopparoxid kan också blandas-används för att få grön, bambugrön, fruktgrön och annan färgglasyr. Dessa färgade glasyrer är emellertid i allmänhet mindre glansiga på grund av påverkan av kromat.
färgglasyren erhållen från kromoxid eller kalium (natrium) dikromat är ofta gulgrön på grund av valensförändringen av kromjoner i smältprocessen. Kaliumdikromat används också ofta för att göra olika gröna pigment och rosa pigment.
kaliumdikromat bör uppfylla de nödvändiga målen: kaliumdikromatinnehåll 99%, kloridinnehåll 0,08%, vattenolösligt 0,05%.
ovanstående information sammanställs av Yaoyao av Chemicalbook.
löslighet i vatten (g/100 ml)
upplöst gram per 100 ml vatten vid olika temperaturer (2CB):
60 g/10 °C, 63.7 g/20 °C, till 66,7 g/30 °C; med 67,8 g/40 °C
70.1 g/60 °C, i 74,5 g/90 °C
Toxicitet
Se natriumkromat
Kemiska egenskaper
citrongul orthorhombic kristall, Lösligt i vatten, löslig i alkohol
Ansökan
Används som analytiskt reagens, oxidant, mordant och metall rost-hämmare;används för tillverkning av kromat,används som antioxidant och mordant för tryckning och färgning. Används för bläck, färg, emalj,metallkorrosion och så vidare, som huvudsakligen används vid tillverkning av kemiska reagenser och pigment.
beredning
Neutraliseringsmetod: Lös upp kaliumdikromat i moderluten och vattnet och tillsätt sedan blandningen till reaktorn. Tillsätt sedan kaliumhydroxid under omrörning för att utföra neutraliseringsreaktion. Det producerade kaliumkromatet är svagt alkaliskt och indunstas sedan för koncentration, kyls för kristallisering, separeras och torkas för att erhålla de färdiga kaliumkromatprodukterna.
K2Cr2O7 + 2KOH 2k2cro4 + H2o
den separerade moderluten kommer att återföras till upplösningssteget för upplösning av kaliumdikromat.
kemiska egenskaper
citrongula kristaller
kemiska egenskaper
kaliumkromat(vi) är ett gult kristallint fast ämne.
använder
kaliumkromat (K2CrO4) är lösligt i vatten och används för att göra ljusgula bläck och färgpigment. Det används också som reagens i kemiska laboratorier och som en mordant för att”fixa” färgämnen i färgade textilier.
använder
det används som ett oxidationsmedel.
använder
har en begränsad tillämpning i emaljer, efterbehandling läder, rostskydd av metaller, ersätts med natriumsalt; som reagens i analytisk kemi.
Definition
ChEBI: ett kaliumsalt bestående av kalium-och kromatjoner i förhållandet 2:1.
Definition
ett salt som innehåller ionCrO42-.
Definition
kaliumkromat: ett ljust gultkristallint fast ämne, K2CrO4, lösligti vatten och olösligt i alkohol; romb; rd 2,73; mp968,3 kcal C; sönderdelas utan kokning. Det produceras industriellt genom att rosta pulveradkromitmalm med kaliumhydroxid och kalksten och lakning den resulterande aska med varmkaliumsulfatlösning. Kaliumkromat används i läderefterbehandling, som textilmordant, och inemeler och pigment. I laboratorietdet används som en analytiskreagent och som en indikator. Likaandra krom (III) föreningar är detgiftigt vid intag eller inandning.
allmän beskrivning
kaliumkromat är ett gult kristallint fast ämne. Kaliumkromat är lösligt i vatten. Den främsta faran är hotet mot miljön. Omedelbara åtgärder bör vidtas för att begränsa dess spridning till miljön. Kaliumkromat används i kemisk analys, för att göra pigment för färger och bläck, som en fungicid och för att göra andra kromföreningar.
luft & Vattenreaktioner
lösliga i vatten.
Reaktivitetsprofil
oxidationsmedel, såsom kaliumkromat, kan reagera med reduktionsmedel för att generera värme och produkter som kan vara gasformiga (orsakar trycksättning av slutna behållare). Produkterna kan själva ha förmåga till ytterligare reaktioner (såsom förbränning i luften). Den kemiska reduktionen av material i denna grupp kan vara snabb eller till och med explosiv, men kräver ofta initiering (värme, gnista, katalysator, tillsats av ett lösningsmedel). Explosiva blandningar av oorganiska oxidationsmedel med reduktionsmedel kvarstår ofta oförändrade under långa perioder om initiering förhindras. Sådana system är vanligtvis blandningar av fasta ämnen, men kan involvera vilken kombination som helst av fysiska tillstånd. Vissa oorganiska oxidationsmedel är salter av metaller som är lösliga i vatten; upplösning späder ut men upphäver inte oxidationskraften hos sådana material. Organiska föreningar har i allmänhet viss reducerande kraft och kan i princip reagera med föreningar i denna klass. Den faktiska reaktiviteten varierar mycket med den organiska föreningens identitet. Oorganiska oxidationsmedel kan reagera våldsamt med aktiva metaller, cyanider, estrar och tiocyanater.
fara
Giftigt vid förtäring och inandning.
hälsorisk
inandning orsakar lokal irritation av slemhinnor; fortsatt näsirritation kan leda till perforering av nasal septum. Förtäring kan orsaka våldsam gastroenterit, cirkulationskollaps, svimmelhet, koma och giftig nefrit; intag av alltför stora mängder kan vara dödligt. Kontakt med ögonen orsakar allvarlig irritation och konjunktivit. Upprepad eller långvarig exponering för damm, dimma eller lösningar kan orsaka dermatit; kontakt med raster i huden kan orsaka `kromsår” som uppträder som långsam läkning, hårdkantade sår som lämnar området sårbart för infektion.
brandrisk
Brandbeteende: kan öka brandintensiteten vid kontakt med brännbara material. Kyl behållare och spillt material med mycket vatten.
säkerhetsprofil
bekräftat cancerframkallande med experimentella tumörgeniska data. Förgiftning genom förtäring, intravenös, subkutan ochintramuskulära vägar. En experimentalteratogen. Andra experimentella reproduktivaeffekter. Mänskliga mutationsdata rapporterade. Apowerful oxidationsmedel. Vid upphettning tilldekomposition det avger giftiga ångor av K2O.används som ett betmedel för ull, i oxiderande och behandling av färgämnen på material. Se ävenkromföreningar.
potentiell exponering
kaliumkromat används vid tryckning: fotomekanisk bearbetning; krom-pigment produktion; och ull konserveringsmedel metoder; att göra färgämnen, pigment, bläck och emaljer; som ett oxidationsmedel; analytiskt reagens; i galvanisering; sprängämnen.
Frakt
UN1479 oxiderande fast ämne, i. o. s., Faroklass: 5.1; etiketter: 5.1-oxidationsmedel, Tekniskt namn krävs. UN3288 giftiga fasta ämnen, oorganiska, n. o. s., Faroklass: 6.1; etiketter: 6.1-giftiga material, Tekniskt namn krävs
reningsmetoder
kristallisera det från konduktivitetsvatten (0,6 g/mL vid 20o) och torka det mellan 135o och 170o.
inkompatibiliteter
ett kraftfullt oxidationsmedel. Våldsamma reaktioner med brännbara ämnen, organiska ämnen, pulverformiga metaller; eller lätt oxiderbara ämnen. Kontakt med hydroxylamin, hydrazin orsakar explosion.