Molekylstruktur avslöjar hur antibiotikumet Streptomycin fungerar / BNL Newsroom
molekylstruktur avslöjar hur antibiotikumet Streptomycin fungerar
September 5, 2013
Streptomycin var det första antibiotikumet som utvecklats för att behandla tuberkulos men tills nyligen förstod forskarna inte helt hur det fungerar på molekylär nivå. De visste att streptomycin blockerar en kritisk process, syntesen av proteiner av ribosomer som leder till bakteriell celldöd, men vissa detaljer om interaktionen förblev oupptäckta. Vid Brookhaven National Laboratory National Synchrotron Light Source har forskare använt röntgenkristallografi för att slutföra bilden.
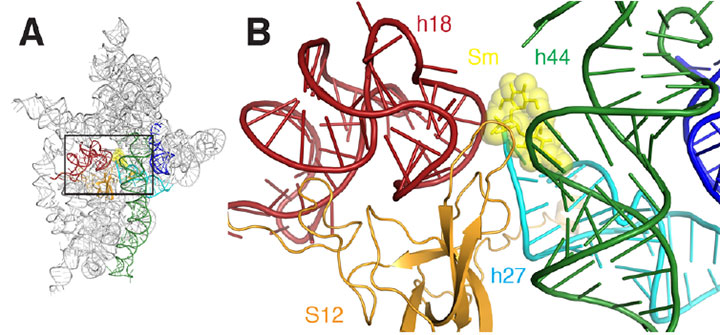
A) ett banddiagram över ribosomens streptomycinbindningsställe. B) en närbild av det rektangulära området som skisseras i A. Streptomycin representeras som gula sHcks och sfärer, spiraler är färgade röda, mörkgröna, cyan, orange och blå.
Streptomycin är medlem i en familj av antibiotika som fungerar genom att avbryta funktionen hos bakteriecellernas ribosomer, de komplexa molekylära maskinerna som skapar proteiner genom att länka aminosyror tillsammans. Ribosomer, ett huvudmål för antibiotika som fungerar genom att hämma syntesen av proteiner, har två huvuddelar eller ”subenheter.”
den större underenheten gör proteinbyggnaden, styrd av en typ av RNA som kallas messenger RNA (mRNA), som binder till den. Den lilla subenheten ”läser” mRNA och väljer matchande överföringsrna (tRNA) – molekylen, som väljer och levererar nästa aminosyra till ribosomen. Det är här streptomycin spelar en roll. Det binder nära den lilla underenheten,vilket får den att felaktigt läsa sekvensen. Detta resulterar i syntesen av slumpmässiga proteiner, som i slutändan dödar bakterierna. Men hur denna felläsning inträffade förblev ett mysterium, tills en ny studie av forskare från Brown University och Multiinstitution Northeastern Collaborative Access Team vid Argonne National Laboratory (förvaltas av Cornell University).
genom att skapa en kristall-en ordnad struktur av identiska enheter-av den lilla ribosomala subenheten bunden till mRNA i närvaro av streptomycin, genererade forskarna flera detaljerade ”ögonblicksbilder” som avslöjade viktiga detaljer på molekylär nivå av interaktionen, vilket i slutändan visar hur streptomycin försämrar subenhetens funktion. Vid NSLS beamline X25 använde de en teknik som kallas röntgenkristallografi, där en röntgenstråle riktar sig mot kristallen, interagerar med molekylerna och ger ett invecklat diffraktionsmönster. Från mönstret, med hjälp av datorprogramvara, konstruerade gruppen visuella representationer av subenheten-mRNA-streptomycinkomplexet.
kort sagt kunde forskarna ” se ” för första gången de subtila sätten på vilka streptomycin snedvrider strukturen hos subenhetens avkodningsplats, vilket gör att den felaktigt läser mRNA. Till exempel minskar streptomycinbindning avståndet mellan två av de många spiraler som utgör subenhetens molekylstruktur. Detta är särskilt viktigt eftersom dessa spiraler bildar den faktiska avkodningsplatsen, och avkodning sker endast korrekt om dessa element är orienterade exakt rätt med avseende på mRNA och det valda tRNA. Streptomycinbindning inducerar också en förändring i förhållandet mellan en av dessa två spiraler och en tredje helix, vilket får en att dra sig tillbaka från den andra eller ”koppla ur.”
slutresultatet av alla dessa små förändringar är att streptomycin destabiliserar bindningen mellan subenheten och det ”korrekta” tRNA samtidigt som subenhetens bindning stabiliseras till ”fel” tRNA, vilket därigenom effektivt avlägsnar diskrimineringen mellan rätt och fel tRNA. Detta orsakar kaos i bakterieförsörjningskedjan för nya proteiner, vilket stör bakteriernas reproduktion och livscykel.
”våra strukturstudier avslöjade att streptomycin inducerar överraskande stora snedvridningar i bakterieribosomen, vilket hjälper oss att förstå hur detta antibiotikum stör proteinsyntesen i bakterier”, säger leadforskare Gerwald Jogl, docent i biologi i Browns molekylärbiologi, cellbiologi & biokemi avdelning. ”Fortsätter vi från våra nuvarande resultat studerar vi nu hur mutationer i bakteriella ribosomer kan motverka dessa strukturella omarrangemang och göra det möjligt för bakterier att överleva streptomycins annars dödliga verkan.”
denna forskning publicerades i Januari 15, 2013 upplagan av Nature Communications, under titeln ” en strukturell grund för streptomycininducerad felläsning av den genetiska koden.”Stöd kom från National Institutes of Health och Department of Energy.
2013-4251/INT | EXT / Newsroom