Der menschliche Amygdaloid-Komplex: Zelluläre Architektur und dopaminerge Innervation
Die dopaminerge Innervation des menschlichen Gehirns
Der AC erhält eine wesentliche dopaminerge Innervation, die hauptsächlich aus den ventralen mesencephalen Gruppen A8, A9 und A10 stammt, und Dopamin ist ein wichtiger Neurotransmitter im AC, der den Informationseintrag durch die basolaterale Gruppe moduliert. Darüber hinaus ist diese dopaminerge Innervation für den Erwerb, die Konsolidierung und die Auslöschung von Angstgedächtnissen sowie für die Erzeugung geeigneter affektiver Reaktionen erforderlich, und, wie bereits erwähnt, wurden Funktionsstörungen dieses dopaminergen Systems als pathogene Mechanismen bei psychiatrischen Erkrankungen wie Schizophrenie und stressbedingten Störungen vorgeschlagen . Genaue quantitative Daten über die Menge an dopaminergen Axonen und deren Verteilung im Blut von menschlichen Spendern, bei denen vor ihrem Tod keine neurologischen oder psychiatrischen Erkrankungen diagnostiziert worden waren, wurden von García‐Amado und Prensa unter Verwendung der DAT-Immunreaktivität als Marker für die dopaminergen Fasern und stereologischen Ansätze gesammelt. Da die intrinsische Dopamininstabilität die Immundetektion in Hirngewebe verhindert, das nach dem Tod des Spenders nicht schnell durch Perfusion fixiert wurde, hatten frühere Studien, die sich auf die Analyse der dopaminergen Innervation des menschlichen GEHIRNS konzentrierten, das TH-Protein zum Nachweis von dopaminergen Profilen verwendet. Das Protein markiert jedoch auch noradrenerge und adrenerge Fasern im AC . Da der AC aus mehreren Kerngruppen mit einer Vielzahl von Verbindungen mit der Großhirnrinde, der Hippocampusbildung, den Basalganglien, dem Thalamus, dem Hypothalamus und dem Hirnstamm besteht (zur Überprüfung siehe Refs. Informationen über den Gehalt an dopaminergen Axonen in jeder der Kerngruppen sind erforderlich, um die interne funktionelle Organisation dieses Komplexes besser zu verstehen.
Das menschliche AC wird von weit verbreiteten DAT‐positiven Fasern angegriffen, die in jeder Unterteilung dieses Kernkomplexes dicht und ungleichmäßig verteilt sind (Abbildungen 2 und 3). Darüber hinaus hat ihre Studie genaue Informationen über die Menge an DAT‐ir-Fasern pro Neuron in jedem Amygdaloidgebiet geliefert. Wie von diesen Autoren gezeigt, variiert die Menge an DAT‐ir-Axonen im menschlichen AC zwischen den verschiedenen Kernen des AC und variiert auch beträchtlich in den verschiedenen Unterteilungen eines gegebenen AC-Kerns (Abbildung 2), was auf funktionelle Variationen zwischen diesen Gebieten hinweist.
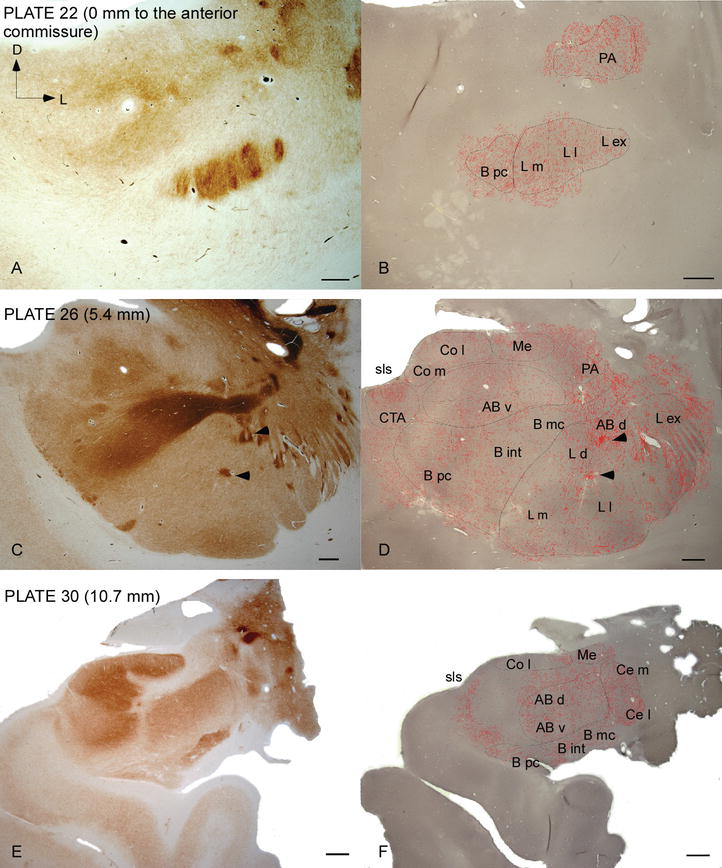
Abbildung 2.
Verteilung von DAT-positiven Fasern im menschlichen AC. Serie von zwei benachbarten koronalen Abschnitten, die für Acetylcholinesterase (AChE) (A, C, E) und DAT (B, D, F) auf drei anteroposterioren Ebenen des AC gefärbt sind, mit den entsprechenden Platten von Ref. . Das Punktieren in B, D und F stellt die DAT‐positiven Axone dar, die mit camera lucida bei 20 × gezeichnet und über die gleichen für DAT gefärbten Mikroaufnahmen gelegt wurden. Pfeilspitzen in C und D weisen auf Flecken mit entweder AChE- bzw. Abkürzungen siehe Tabelle 1. Skala bar: 1mm.
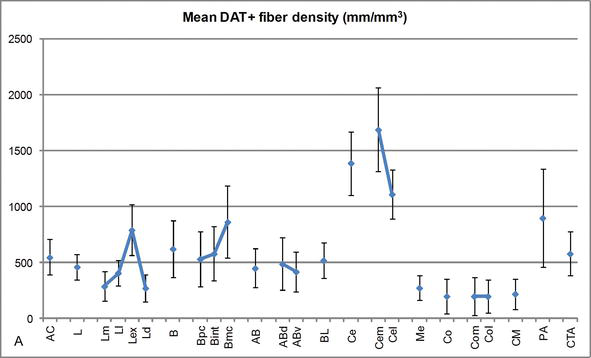
Abbildung 3.
Längendichte von DAT-positiven Fasern im menschlichen Körper. Mittlere DAT-positive Faserlängendichte für jede Kerngruppe, Kern und Kernunterteilung des AC. Die Fehlerbalken stellen die Standardabweichung dar. Abkürzungen siehe Tabelle 1. Modifiziert von García-Amado und Prensa .
Einer der auffälligsten Gradienten in der Menge der DAT‐ir-Fasern trat entlang der mediolateralen Achse des lateralen Kerns auf: Die Gesamtlänge der DAT‐ir-Axone reicht von fast 300 mm / mm3 in seiner medialen Unterteilung bis fast 800 mm / mm3 an seiner äußeren (lateralsten) Unterteilung (Abbildungen 2 und 3). Diese große Variation in der Menge der DAT‐ir-Fasern zwischen den medialen und lateralen Sektoren des lateralen Kerns könnte mit ihren differenzierten extrinsischen und intrinsischen Verbindungen zusammenhängen. Somit wäre der laterale Kern das Hauptziel sensorischer Informationen aus der Außenwelt und sendet schwere Projektionen an die anderen Amygdaloidkerne . Die äußere Unterteilung des lateralen Kerns empfängt die meisten dieser sensorischen Projektionen (Abbildungen 2 und 3), und die Information fließt in Richtung der medialen Seite des Kerns ; Darüber hinaus hat diese AC-Region die kürzeste Latenz konditionierter Reaktionen, die durch sensorische Reize hervorgerufen werden, die mit unerwünschten Ereignissen bei emotionalen Lernaufgaben verbunden sind . Andererseits erhält die mediale Unterteilung des lateralen Kerns Informationen aus kortikalen Verarbeitungsbereichen höherer Ordnung . Im Hippocampus waren DAT‐positive Axone nur in den äußeren zwei Dritteln der molekularen Schicht des Gyrus dentatus vorhanden, wo der perforante Weg endet , was darauf hinweist, dass Dopamin den Input aus dem entorhinalen Kortex und damit die frühen Stadien der Hippocampus‐Verarbeitung stark und selektiv regulieren kann, wie dies bei den sensorischen Informationen der Fall sein könnte, die in den AC-Lateralkern gelangen.
Der zentrale Kern empfängt Informationen von den übrigen Wechselstromkernen und ist einer der Hauptausgangskerne des Wechselstroms . Absteigende Projektionen vom zentralen Kern enden in einer breiten mediolateralen Region mesencephaler Dopaminzellen . Im Gegenzug erhält dieser Kern die schwerste DAT-positive dopaminerge Innervation aller AC-Kerne, jedoch ist seine Innervation nicht gleichmäßig verteilt und nimmt entlang eines mediolateralen Gradienten deutlich ab, ein Befund, der mit dem Verteilungsmuster von TH‐ir-Fasern übereinstimmt . In den basalen und akzessorischen Basalkernen des AC nimmt der Gehalt an DAT‐ir-Fasern vom dorsalen zum ventralen Sektor ab, obwohl dieser Gradient im letzteren viel weniger ausgeprägt ist als im ersteren Kern (siehe Abbildung 2A und B).
Die Regulation des extrazellulären Dopaminspiegels wird durch verschiedene Mechanismen in verschiedenen Hirnarealen gesteuert und hängt wahrscheinlich mit dem DAT-Gehalt zusammen. Während also das dorsale Striatum und der Nucleus accumbens eine „aufnahmedominierte“ Regulation (d.h. der mediale präfrontale Kortex und der AC zeigen eine „freisetzungsdominierte“ Regulation (dh Dopamin bleibt länger im extrazellulären Raum erhalten); Diese Ergebnisse stimmen mit der Beobachtung überein, dass im Striatum mehr DAT vorhanden ist als in den beiden anderen Strukturen .
Der AC ist ein Hauptziel für Mesencephalonprojektionen, die aus Zellen der Substantia nigra pars compacta (A9-dopaminerge Gruppe), des ventralen Tegmentbereichs (A10-dopaminerge Gruppe) und des retrorubralen Feldes (A8-dopaminerge Gruppe) bestehen . Im menschlichen Mesencephalon ist DAT reich an Neuronen, die sich im lateralen ventralen Tegmentalbereich und in der Substantia nigra pars compacta befinden, und fehlt weitgehend im medialen ventralen Tegmentalbereich . DAT-mRNA ist in der ventralen A9-Ebene häufiger als in der dorsalen Ebene . Die menschlichen AC-Kerne, die die meisten DAT‐ir-Fasern enthalten, entsprechen denen, die starke Projektionen vom ventralen Mesencephalon erhalten, wie dies auch bei Primaten beobachtet wird . Es gibt jedoch andere AC-Regionen, die eine hohe Dichte an DAT‐positiven Fasern aufweisen, wie die laterale Unterteilung des zentralen Kerns, die von keinem Teil des ventralen Mittelhirns innerviert zu werden scheinen . Es gibt andere mögliche Quellen von AC-Dopamin, die außerhalb des ventralen Mittelhirns liegen, aber ob sie zu den DAT‐ir-Fasern beitragen, die im AC auftreten oder nicht, ist noch nicht klar. Der Parabrachialkern projiziert auf die zentralen und medialen Kerne des AC und enthält mutmaßlich dopaminerge Neuronen, die kein DAT tragen . Darüber hinaus fehlt den Neuronen des Parabrachialkerns, die zum AC projizieren, auch die Tyrosinhydroxylase (TH) . Die periaqueduktale graue Substanz ist eine weitere Eingangsquelle für den AC und enthält dopaminerge Neuronen (d. H. A11-Gruppe), die DAT enthalten und auf die zentralen und medialen AC-Kerne projizieren . Diese dopaminerge Verbindung ist relevant, da sie spezifisch auf die laterale Unterteilung des zentralen Kerns abzielt, eine Region, die efferente Projektionen an die mediale Unterteilung des zentralen Kerns sendet, die wiederum auf die periaqueduktale graue Substanz projiziert, die das „Einfrieren“ -Verhalten bei Tieren behandelt, die einem potenziell gefährlichen Reiz ausgesetzt sind . Es gibt auch TH + -Zellen im dorsalen Raphe-Kern, die zum zentralen AC-Kern projizieren , aber der DAT-Gehalt dieser Zellen wurde noch nicht bestimmt.
Die ultrastrukturelle Lokalisation von DAT im Primaten AC ist derzeit unbekannt. In der Großhirnrinde entsprechen die meisten DAT-markierten Profile dünnen, nicht myelinisierten Axonen, die selten Synapsen bilden, während TH‐markierte Profile mehr in ihrem Durchmesser variieren und TH‐ir-Varikositäten reichlich Vesikel enthalten und häufig Synapsen bilden . Folglich Lewis et al. glauben Sie, dass DAT wahrscheinlich auf die intervarikosen Segmente beschränkt ist . Die spezifischen postsynaptischen Ziele der dopaminergen Fasern, die das menschliche Gehirn erreichen, sind nicht bekannt. Mehrere Studien an Nagetieren haben gezeigt, dass diese Fasern Synapsen sowohl mit Projektionsneuronen als auch mit Interneuronen bilden . Obwohl Projektionsneuronen die Mehrheit der dopaminergen Synapsen erhalten , werden auch die CR + – und PV + -Interneuron-Teilmengen von diesen Fasern innerviert, insbesondere von denen, die PV enthalten . Die CR + -Interneurone erhalten nur 6% der dopaminergen Synapsen, während die PV + -Zellen 40% erhalten . In den zentralen und basalen Kernen sowie in den parakapsulär interkalierten Gruppen bilden die dopaminergen Terminals häufiger symmetrische Synapsen als asymmetrische .
Dopaminerge Fasern im AC bilden perineuronale Netze um das Soma der Projektionsneuronen und der PV + -Interneurone, und 72% der Kontakte, die diese Netze mit den PV + -Interneuronen herstellen, sind synaptisch . Diese Netze sind in etwa 10-15% aller PV + -Interneuronen reichlich vorhanden und scheinen andere Interneuron-Untergruppen zu meiden. Diese Netze hängen funktionell mit der starken Hemmung zusammen, die in der Aktivität der Projektionsneuronen der basolateralen Gruppe nach Dopaminfreisetzung beobachtet wird . Die dopaminerge Innervation der verschiedenen Interneuronpopulationen des AC könnte zur Induktion von Langzeitpotenzierungsmechanismen beitragen, die an der konditionierten Angstakquisition beteiligt sind, was eine Unterdrückung der gabaergen Interneuronhemmung von Projektionsneuronen erfordert . Dopamin hemmt die „schnell feuernden“ Interneurone, die mit den PV + -Interneuronen zusammenfallen , und reduziert die Hemmung von Projektionsneuronen im lateralen Amygdaloidkern. In jüngerer Zeit haben Chu et al. haben gezeigt, dass Dopamin die GABA-Freisetzung von PV + -Interneuronen zu Projektionsneuronen blockiert, die auf präsynaptische Rezeptoren vom Typ D2 wirken, die Freisetzung von GABA an andere Interneurontypen aus dieser Interneuronpopulation jedoch nicht beeinflussen . Die Blockade von D1- und D2-Rezeptoren in der basolateralen Gruppe verhindert den Erwerb von Angst .