Humano Complexo Amigdaliano: Arquitetura Celular e Inervação Dopaminérgica
A inervação dopaminérgica do ser humano AC
O transformador recebe uma substancial inervação dopaminérgica originários principalmente da A8, A9 e A10 mesencefálica ventral grupos e a dopamina é um dos principais neurotransmissores do CA, que modula a entrada de informações através do basolateral grupo. Além disso, esta inervação dopaminérgica é necessário para a aquisição, consolidação e extinção de medo memórias, bem como para a geração apropriada respostas afetivas e, como mencionado anteriormente, disfunções deste dopaminérgico tem sido propostos como mecanismos patogênicos de doenças psiquiátricas como esquizofrenia e transtornos relacionados ao estresse . Dados quantitativos precisos sobre a quantidade de axônios dopaminérgicos e sua distribuição no AC de doadores humanos que não tinham sido diagnosticados com doenças neurológicas ou psiquiátricas antes de sua morte foram coletados por García‐Amado e Prensa usando a imunoreatividade DAT como um marcador para as fibras dopaminérgicas e abordagens estereológicas. Uma vez que a instabilidade intrínseca da dopamina impede a sua imunodetecção no tecido cerebral que não foi rapidamente fixada por perfusão após a morte do dador, estudos anteriores que se centraram na análise da inervação dopaminérgica da AC humana utilizaram a TH proteína para detectar perfis dopaminérgicos. No entanto, a proteína T também rotula fibras noradrenérgicas e adrenérgicas na AC . Uma vez que o AC consiste de vários grupos nucleares com uma vasta gama de interconexões com o córtex cerebral, formação hipocampal, gânglios basais, tálamo, hipotálamo, e brainstem (para revisão veja Refs. ), a informação sobre o conteúdo dos axônios dopaminérgicos em cada um dos grupos nucleares é necessária para entender melhor a organização funcional interna deste complexo.
a AC humana é visada por fibras dat‐positivas generalizadas, que são densas e desigualmente distribuídas em cada subdivisão deste complexo nuclear (Figuras 2 e 3). Além disso, seu estudo forneceu informações precisas sobre a quantidade de fibras DAT‐ir por neurônio em cada território amígdalóide. Como demonstrado por estes autores, a quantidade de axões DAT‐ir na AC humana varia entre os vários núcleos da AC e também varia consideravelmente nas várias subdivisões de um determinado núcleo AC (Figura 2), indicando variações funcionais entre estes territórios.
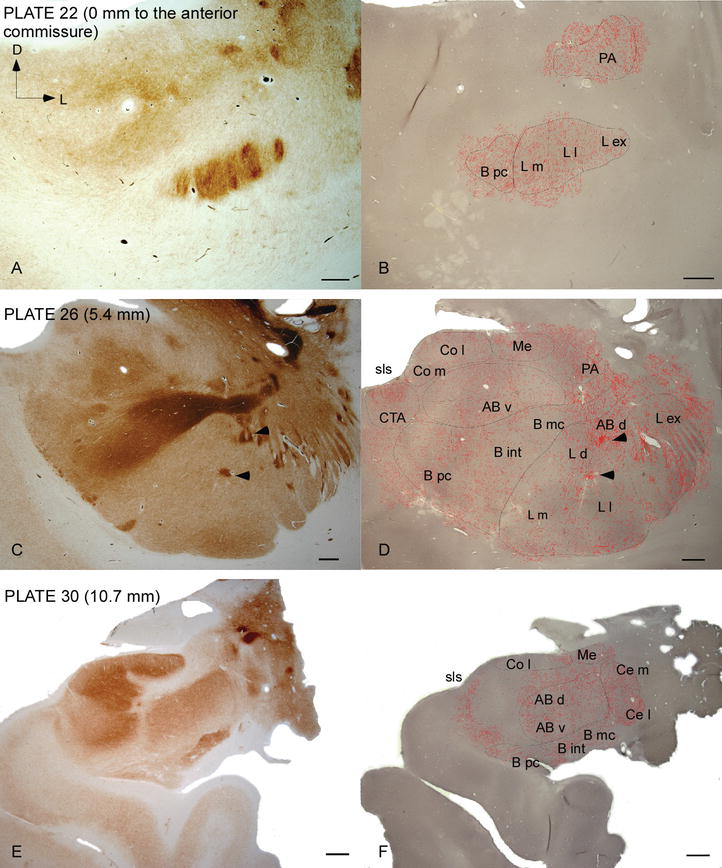
Figura 2.
distribuição de fibras dat positivas no AC humano. Série de duas secções coronais adjacentes manchada para a acetilcolinesterase (AChE) (a, C, E) e DAT (B, D, F) A Três níveis anteroposterior da AC, com as placas correspondentes da Ref. . O pontilhamento em B, D E F representa os axônios dat-positivos desenhados com a câmera lucida a 20× e sobrepostos sobre os mesmos micrografos manchados para DAT. As pontas de flechas em C E D indicam manchas enriquecidas com AChE ou DAT, respectivamente. Para abreviaturas, ver Quadro 1. Barra de escala: 1 mm.
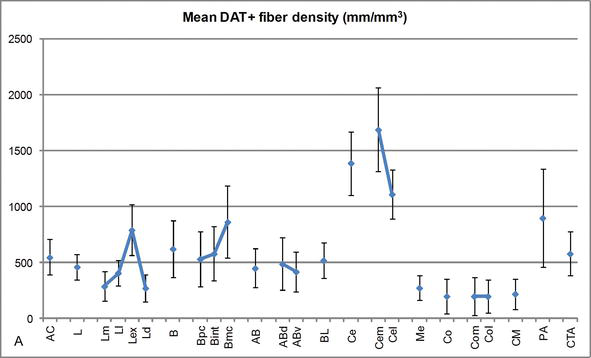
Figura 3.
comprimento densidade de fibras dat positivas no AC humano. Densidade média de comprimento da fibra dat positiva para cada grupo nuclear, núcleo e subdivisão nuclear da AC. As barras de erro representam o desvio padrão. Para abreviaturas, ver Quadro 1. Modificado de García-Amado e Prensa .
Uma das mais marcantes de gradientes montante da DAT‐ir fibras ocorreu ao longo do eixo médio-lateral lateral núcleo: o comprimento total da DAT‐ir axônios intervalo de cerca de 300 mm/mm3 no seu medial subdivisão para quase 800 mm/mm3 em sua externo (mais lateral) subdivisão (Figuras 2 e 3). Esta grande variação na quantidade de fibras DAT‐ir entre os setores medial e lateral do núcleo lateral pode estar relacionada com suas conexões extrínsecas e intrínsecas diferenciadas. Assim, o núcleo lateral seria o principal alvo de informações sensoriais do mundo externo, e envia projeções pesadas para os outros núcleos amígdalóides . Externo subdivisão do lateral núcleo recebe a maioria dessas projeções sensoriais (Figuras 2 e 3), e os fluxos de informação para o lado medial do núcleo ; além disso, este CA a região tem a menor latência de respostas condicionadas eliciadas por estímulos sensoriais associadas com eventos adversos no emocional tarefas de aprendizagem . Por outro lado, a subdivisão medial do núcleo lateral recebe informações de áreas de processamento cortical de ordem superior . No hipocampo, DAT‐positivo axônios estavam presentes apenas no exterior, dois terços da camada molecular do giro denteado, onde o perforant percurso termina , indicando que a dopamina pode potente e seletivamente regular a entrada do córtex entorrinal e, portanto, as fases iniciais de hipocampo de processamento, como pode ser o caso para as informações sensoriais que entram CA lateral núcleo.
o núcleo central recebe informação do resto dos núcleos AC e é um dos principais núcleos de saída da AC . Projeções descendentes do núcleo central terminam numa vasta região mediolateral de células dopaminérgicas mesencéficas . Por sua vez, este núcleo recebe a mais pesada inervação dopaminérgica DAT‐positiva de todos os núcleos AC, no entanto a sua inervação não é uniformemente distribuída e diminui acentuadamente ao longo de um gradiente mediolateral, uma constatação que concorda com o padrão de distribuição das fibras TH‐ir . Nos núcleos basais basais basais basal e acessório da AC, o conteúdo das fibras DAT‐ir diminui dos setores dorsal para ventral, embora este gradiente seja muito menos marcado neste último do que no núcleo anterior (ver Figura 2A e B) .
a regulação dos níveis de dopamina extracelular é controlada por mecanismos distintos em diferentes áreas cerebrais e está provavelmente relacionada com o teor de DAT. Assim, enquanto que o estriato dorsal e o núcleo accumbens mostram uma regulação “dominada pela captação” (i.e. um em que a dopamina é rapidamente recapturada do espaço extracelular para acabar com a sua acção), o córtex pré‐frontal medial e o AC mostram uma regulação “dominada pela libertação” (isto é, a dopamina é mantida no espaço extracelular mais tempo) ; estes resultados concordam com a observação de que há mais DAT no estriado do que nas outras duas estruturas .
a AC é o principal alvo para projeções mesencéfalas feitas de células da substância nigra pars compacta (grupo dopaminérgico A9), a área tegmental ventral (Grupo dopaminérgico A10) e o campo retrorrubral (grupo dopaminérgico A8) . No mesencéfalo humano, o DAT abunda em neurônios localizados na área tegmental ventral lateral e na substância nigra pars compacta e está largamente ausente da área tegmental ventral medial . Dat mRNA é mais abundante no nível ventral A9 do que no nível dorsal . Os núcleos AC humanos que contêm a maioria das fibras DAT-ir correspondem àqueles que recebem fortes projeções do mesencéfalo ventral, como também observado em primatas . Existem, no entanto, outras regiões AC mostrando uma alta densidade de fibras dat-positivas, tais como a subdivisão lateral do núcleo central, que não parecem receber inervação de qualquer parte do mesencéfalo ventral . Existem outras fontes possíveis de dopamina AC que se encontram fora do mesencéfalo ventral, mas se contribuem para as fibras DAT-ir encontradas no AC ou não, ainda não é claro. O núcleo parabraquial projeta-se para os núcleos central e medial da AC e contém neurônios putativamente dopaminérgicos que não carregam DAT . Além disso, os neurônios do núcleo parabraquial que se projetam para o AC também carecem de tirosina hidroxilase (TH) . A substância cinza periaqueductal é outra fonte de entrada para o AC e contém neurônios dopaminérgicos (ou seja, grupo A11) que contêm DAT e projetam-se para os núcleos AC central e medial . Essa ligação dopaminérgica é relevante, pois esta visa especificamente o lateral subdivisão do núcleo central, uma região que envia eferentes para o medial subdivisão do núcleo central, que por sua vez, os projetos de volta para a substância cinzenta periaquedutal tratamento de “congelamento” de comportamento em animais expostos a uma potencialmente perigosa estímulo . Há também células TH+ no núcleo dorsal do raphe que se projetam para o núcleo central de AC, mas o conteúdo DAT destas células ainda não foi determinado.
a localização ultra-estrutural do DAT no primata AC é actualmente desconhecida. No córtex cerebral, a maioria dos perfis marcados DAT correspondem a axônios finos não‐mielinados que raramente formam sinapses, enquanto os perfis marcados com TH variam mais em seu diâmetro e as varicósias de th‐ir contêm vesículas abundantes e frequentemente formam sinapses . Consequentemente, Lewis et al. considera que a DAT é susceptível de se restringir aos segmentos da intervaricose . Não se conhecem os alvos pós-sinápticos específicos das fibras dopaminérgicas que atingem a AC humana. Vários estudos em roedores demonstraram que estas fibras fazem sinapses com neurônios de projeção e interneurões . Embora os neurônios de projeção recebam a maioria das sinapses dopaminérgicas, os subconjuntos CR+ e PV+ interneuron também são inervados por essas fibras, especialmente as que contêm PV . As interneurões CR+ recebem apenas 6% das sinapses dopaminérgicas, enquanto as células PV+ recebem 40% . Nos núcleos Central e basal, bem como nos grupos intercalados parapsulares, os terminais dopaminérgicos formam sinapses simétricas com maior frequência do que as assimétricas .
fibras dopaminérgicas na forma AC redes perineuronais em torno do soma dos neurônios de projeção e dos interneurões PV+, e 72% dos contatos que estas redes estabelecem com os interneurões PV+ são sinápticos . Estas redes são abundantes em cerca de 10-15% de todos os interneurões fotovoltaicos e parecem evitar outros subconjuntos de interneuros. Estas redes estão funcionalmente relacionadas com a forte inibição observada na actividade dos neurónios de projecção do grupo basolateral após a libertação de dopamina . A inervação dopaminérgica das várias populações de interneuron da AC pode contribuir para a indução de mecanismos de potenciação a longo prazo envolvidos na aquisição condicionada do medo, o que requer a supressão da inibição GABAérgica do interneuron dos neurônios de projeção . A dopamina inibe os interneurões de “disparo rápido”, que coincidem com os interneurões PV+, e reduz a inibição da projecção de neurónios no núcleo amígdalóide lateral. Mais recentemente, Chu et al. demonstraram que a dopamina bloqueia a libertação de GABA dos interneurões PV+ para os neurónios de projecção que actuam nos receptores pré-sinápticos do tipo D2, mas não afecta a libertação de GABA para outros tipos de interneuron desta população de interneuron . O bloqueio dos receptores D1 e D2 no grupo basolateral impede a aquisição condicionada do medo .