Umano Amygdaloid Complesso: Architettura Cellulare e Innervazione Dopaminergica
L’innervazione dopaminergica umano AC
L’AC riceve un notevole innervazione dopaminergica provenienti principalmente dalla A8, A9 e A10 ventrale mesencefaliche gruppi e la dopamina è un neurotrasmettitore chiave in AC che modula la voce di informazioni attraverso il basolaterale gruppo. Inoltre, questa innervazione dopaminergica è necessaria per l’acquisizione, il consolidamento e l’estinzione dei ricordi di paura, nonché per generare risposte affettive appropriate e, come accennato in precedenza, le disfunzioni di questo sistema dopaminergico sono state proposte come meccanismi patogeni in malattie psichiatriche come la schizofrenia e disturbi legati allo stress . Dati quantitativi accurati riguardanti la quantità di assoni dopaminergici e la loro distribuzione nell’AC da donatori umani che non erano stati diagnosticati con malattie neurologiche o psichiatriche prima della loro morte sono stati raccolti da García‐Amado e Prensa usando l’immunoreattività DAT come marker per le fibre dopaminergiche e gli approcci stereologici. Poiché l’instabilità intrinseca della dopamina impedisce la sua immunodetezione nel tessuto cerebrale che non è stata rapidamente fissata dalla perfusione dopo la morte del donatore, studi precedenti incentrati sull’analisi dell’innervazione dopaminergica dell’AC umano avevano usato la proteina TH per rilevare i profili dopaminergici. Tuttavia, la proteina TH etichetta anche le fibre noradrenergiche e adrenergiche nell’AC . Poiché l’AC è costituito da diversi gruppi nucleari con una vasta gamma di interconnessioni con la corteccia cerebrale, la formazione dell’ippocampo, i gangli della base, il talamo, l’ipotalamo e il tronco cerebrale (per la revisione vedere Rifs. ), sono necessarie informazioni sul contenuto degli assoni dopaminergici in ciascuno dei gruppi nucleari per comprendere meglio l’organizzazione funzionale interna di questo complesso.
L’AC umano è preso di mira da diffuse fibre DAT‐positive, che sono dense e distribuite in modo non uniforme in ogni suddivisione di questo complesso nucleare (Figure 2 e 3). Inoltre, il loro studio ha prodotto informazioni accurate sulla quantità di fibre DAT‐ir per neurone in ciascun territorio amigdaloide. Come mostrato da questi autori, la quantità di assoni DAT‐ir nell’AC umano varia tra i diversi nuclei dell’AC e varia anche considerevolmente nelle varie suddivisioni di un dato nucleo AC (Figura 2), indicando variazioni funzionali tra questi territori.
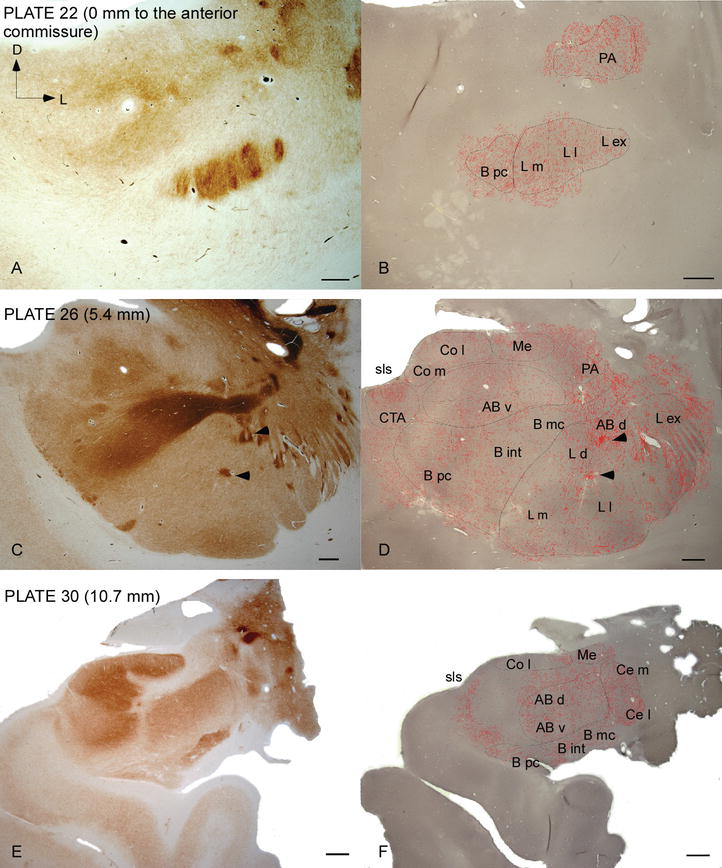
Figura 2.
Distribuzione delle fibre DAT-positive nell’AC umano. Serie di due sezioni coronali adiacenti macchiato per acetilcolinesterasi (AChE) (A, C, E) e DAT (B, D, F) a tre livelli anteroposteriore del AC, con le piastre corrispondenti da Ref. . La punteggiatura in B, D e F rappresenta gli assoni DAT-positivi disegnati con camera lucida a 20× e sovrapposti agli stessi micrografi colorati per DAT. Punte di freccia in C e D indicano patch con AChE o DAT arricchito colorazione, rispettivamente. Per le abbreviazioni cfr. Tabella 1. Scala bar: 1mm.
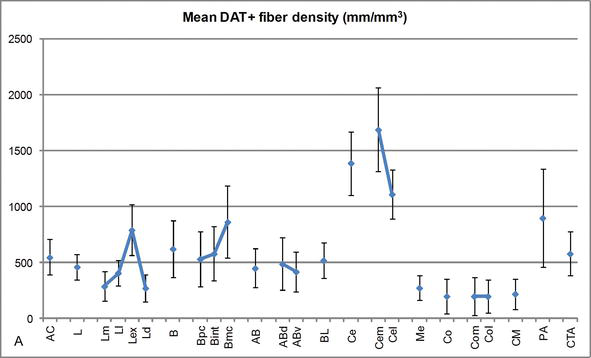
Figura 3.
Densità di lunghezza delle fibre DAT-positive nell’AC umano. Densità media di lunghezza della fibra DAT-positiva per ogni gruppo nucleare, nucleo e suddivisione nucleare dell’AC. Le barre di errore rappresentano la deviazione standard. Per le abbreviazioni cfr. Tabella 1. Modificato da García-Amado e Prensa .
Uno dei gradienti più sorprendenti nella quantità delle fibre DAT-ir si è verificato lungo l’asse mediolaterale del nucleo laterale: la lunghezza totale degli assoni DAT‐ir varia da quasi 300 mm/mm3 nella sua suddivisione mediale a quasi 800 mm/mm3 nella sua suddivisione esterna (più laterale) (Figure 2 e 3). Questa grande variazione nella quantità di fibre DAT-ir tra i settori mediale e laterale del nucleo laterale potrebbe essere correlata alle loro connessioni estrinseche e intrinseche differenziate. Pertanto, il nucleo laterale sarebbe l’obiettivo principale delle informazioni sensoriali dal mondo esterno e invia proiezioni pesanti agli altri nuclei amigdaloidi . La suddivisione esterna del nucleo laterale riceve la maggior parte di queste proiezioni sensoriali (Figure 2 e 3) e le informazioni fluiscono verso il lato mediale del nucleo ; inoltre, questa regione AC ha la più breve latenza di risposte condizionate suscitate da stimoli sensoriali associati a eventi avversi in compiti di apprendimento emotivo . D’altra parte, la suddivisione mediale del nucleo laterale riceve informazioni dalle aree di elaborazione corticale di ordine superiore . Nell’ippocampo, gli assoni DAT‐positivi erano presenti solo nei due terzi esterni dello strato molecolare del giro dentato, dove termina la via perforante , indicando che la dopamina può regolare in modo potente e selettivo l’ingresso dalla corteccia entorinale e quindi le prime fasi dell’elaborazione dell’ippocampo, come potrebbe essere il caso delle informazioni sensoriali che entrano nel nucleo laterale AC.
Il nucleo centrale riceve informazioni dal resto dei nuclei AC ed è uno dei principali nuclei di uscita dell’AC . Le proiezioni discendenti dal nucleo centrale terminano in un’ampia regione mediolaterale delle cellule mesencefaliche della dopamina . A sua volta, questo nucleo riceve la più pesante innervazione dopaminergica DAT‐positiva di tutti i nuclei AC, tuttavia la sua innervazione non è distribuita uniformemente e diminuisce marcatamente lungo un gradiente mediolaterale, una scoperta che concorda con il modello di distribuzione delle fibre TH‐ir . Nei nuclei basali basali e accessori dell’AC, il contenuto nelle fibre DAT‐ir diminuisce dai settori dorsale a ventrale, sebbene questo gradiente sia molto meno marcato in quest’ultimo rispetto al nucleo precedente (vedi Figura 2A e B) .
La regolazione dei livelli di dopamina extracellulare è controllata da meccanismi distinti in diverse aree cerebrali ed è probabilmente correlata al contenuto di DAT. Così, mentre lo striato dorsale e il nucleo accumbens mostrano una regolazione “dominata dall’assorbimento” (cioè uno in cui la dopamina viene rapidamente riconquistata dallo spazio extracellulare per terminare la sua azione), la corteccia prefrontale mediale e l’AC mostrano una regolazione “dominata dal rilascio” (cioè la dopamina viene mantenuta nello spazio extracellulare più tempo); questi risultati concordano con l’osservazione che c’è più DAT nello striato che nelle altre due strutture .
L’AC è un obiettivo principale per le proiezioni del mesencefalo costituite da cellule della substantia nigra pars compacta (gruppo dopaminergico A9), dell’area tegmentale ventrale (gruppo dopaminergico A10) e del campo retrorubrale (gruppo dopaminergico A8) . Nel mesencefalo umano, DAT abbonda di neuroni situati nell’area tegmentale ventrale laterale e nella substantia nigra pars compacta ed è in gran parte assente dall’area tegmentale ventrale mediale . L’mRNA DAT è più abbondante nel livello ventrale A9 che nel livello dorsale . I nuclei umani AC che contengono il maggior numero di fibre DAT-ir corrispondono a quelli che ricevono forti proiezioni dal mesencefalo ventrale, come osservato anche nei primati . Esistono, tuttavia, altre regioni AC che mostrano un’alta densità di fibre DAT‐positive, come la suddivisione laterale del nucleo centrale, che non sembrano ricevere innervazione da nessuna parte del mesencefalo ventrale . Ci sono altre possibili fonti di dopamina AC che si trovano al di fuori del mesencefalo ventrale, ma se contribuiscono alle fibre DAT‐ir incontrate nell’AC o meno, non è ancora chiaro. Il nucleo parabrachiale proietta ai nuclei centrali e mediali dell’AC e contiene neuroni dopaminergici putativi che non portano DAT . Inoltre, i neuroni del nucleo parabrachiale che proiettano verso l’AC mancano anche di tirosina idrossilasi (TH) . La sostanza grigia periaqueduttale è un’altra fonte di input per l’AC e contiene neuroni dopaminergici (cioè gruppo A11) che contengono DAT e proiettano ai nuclei AC centrali e mediali . Questa connessione dopaminergica è rilevante in quanto mira specificamente alla suddivisione laterale del nucleo centrale, una regione che invia proiezioni efferenti alla suddivisione mediale del nucleo centrale, che a sua volta proietta verso la sostanza grigia periaqueduttale che gestisce il comportamento di “congelamento” negli animali esposti a uno stimolo potenzialmente pericoloso . Ci sono anche cellule TH+ nel nucleo del rafe dorsale che proiettano verso il nucleo centrale AC , ma il contenuto di DAT di queste cellule non è stato ancora determinato.
La localizzazione ultrastrutturale di DAT nel primate AC è sconosciuta al momento. Nella corteccia cerebrale, la maggior parte dei profili etichettati con DAT corrisponde a sottili assoni non mielinizzati che raramente formano sinapsi, mentre i profili etichettati con TH variano di più nel loro diametro e le varicosità TH‐ir contengono vescicole abbondanti e spesso formano sinapsi . Di conseguenza, Lewis et al. credo che DAT è probabile che sia limitato ai segmenti intervaricose . Gli obiettivi postsinaptici specifici delle fibre dopaminergiche che raggiungono l’AC umano non sono noti. Diversi studi sui roditori hanno dimostrato che queste fibre producono sinapsi sia con i neuroni di proiezione che con gli interneuroni . Sebbene i neuroni di proiezione ricevano la maggior parte delle sinapsi dopaminergiche , i sottoinsiemi di interneurone CR+ e PV+ sono anche innervati da queste fibre, specialmente quelle contenenti PV . Gli interneuroni CR + ricevono solo il 6% delle sinapsi dopaminergiche, mentre le cellule PV+ ricevono il 40%. Nei nuclei centrali e basali, così come nei gruppi intercalati paracapsulari, i terminali dopaminergici formano sinapsi simmetriche più frequentemente di quelle asimmetriche .
Le fibre dopaminergiche nella forma AC reti perineuronali attorno al soma dei neuroni di proiezione e degli interneuroni PV+, e il 72% dei contatti che queste reti stabiliscono con gli interneuroni PV+ sono sinaptici . Queste reti sono abbondanti in circa il 10-15% di tutti gli interneuroni PV+ e sembrano evitare altri sottoinsiemi di interneuroni. Queste reti sono funzionalmente correlate con la forte inibizione osservata nell’attività dei neuroni di proiezione del gruppo basolaterale dopo il rilascio di dopamina . L’innervazione dopaminergica delle varie popolazioni di interneuroni dell’AC potrebbe contribuire all’induzione di meccanismi di potenziamento a lungo termine coinvolti nell’acquisizione della paura condizionata, che richiede la soppressione dell’inibizione gabaergica dell’interneurone dei neuroni di proiezione . La dopamina inibisce gli interneuroni” fast firing”, che coincidono con gli interneuroni PV+ e riduce l’inibizione dei neuroni di proiezione nel nucleo amigdaloide laterale. Più recentemente, Chu et al. hanno dimostrato che la dopamina blocca il rilascio di GABA dagli interneuroni PV + ai neuroni di proiezione che agiscono sui recettori presinaptici di tipo D2, ma non influisce sul rilascio di GABA ad altri tipi di interneuroni da questa popolazione di interneuroni . Il blocco di entrambi i recettori D1 e D2 nel gruppo basolaterale impedisce l’acquisizione condizionata dalla paura .