Complexul amigdaloid uman: arhitectura celulară și inervația dopaminergică
inervația dopaminergică a acului uman
AC primește o inervație dopaminergică substanțială originară în principal din grupurile mezencefalice ventrale A8, A9 și A10, iar dopamina este un neurotransmițător cheie în AC care modulează intrarea informațiilor prin grupul bazolateral. Mai mult, această inervație dopaminergică este necesară pentru dobândirea, consolidarea și stingerea amintirilor de frică, precum și pentru generarea de răspunsuri afective adecvate și, așa cum am menționat anterior, disfuncțiile acestui sistem dopaminergic au fost propuse ca mecanisme patogene în bolile psihiatrice, cum ar fi schizofrenia și tulburările legate de stres . Datele cantitative exacte privind cantitatea de axoni dopaminergici și distribuția lor în AC de la donatorii umani care nu fuseseră diagnosticați cu boli neurologice sau psihiatrice înainte de deces au fost colectate de Garcia‐Amado-Amado și Prensa utilizând imunoreactivitatea DAT ca marker pentru fibrele dopaminergice și abordările stereologice. Deoarece instabilitatea intrinsecă a dopaminei împiedică imunodetecția sa în țesutul cerebral care nu a fost fixat rapid prin perfuzie după moartea donatorului, studiile anterioare care s-au concentrat pe analiza inervației dopaminergice a AC uman au folosit proteina TH pentru a detecta profilurile dopaminergice. Cu toate acestea, proteina TH etichetează și fibrele noradrenergice și adrenergice din AC . Deoarece AC constă din mai multe grupuri nucleare cu o gamă largă de interconexiuni cu cortexul cerebral, formarea hipocampului, ganglionii bazali, talamusul, hipotalamusul și trunchiul cerebral (pentru revizuire vezi Refs. ), sunt necesare informații privind conținutul axonilor dopaminergici în fiecare dintre grupurile nucleare pentru a înțelege mai bine organizarea funcțională internă a acestui complex.
AC uman este vizat de fibre DAT‐pozitive răspândite, care sunt dense și distribuite inegal în fiecare subdiviziune a acestui complex nuclear (figurile 2 și 3). Mai mult, studiul lor a oferit informații exacte cu privire la cantitatea de fibre DAT‐ir pe neuron în fiecare teritoriu amigdaloid. După cum arată acești autori, cantitatea de axoni DAT‐ir din AC uman variază între mai multe nuclee ale AC și, de asemenea, variază considerabil în diferitele subdiviziuni ale unui nucleu AC dat (Figura 2), indicând variații funcționale între aceste teritorii.
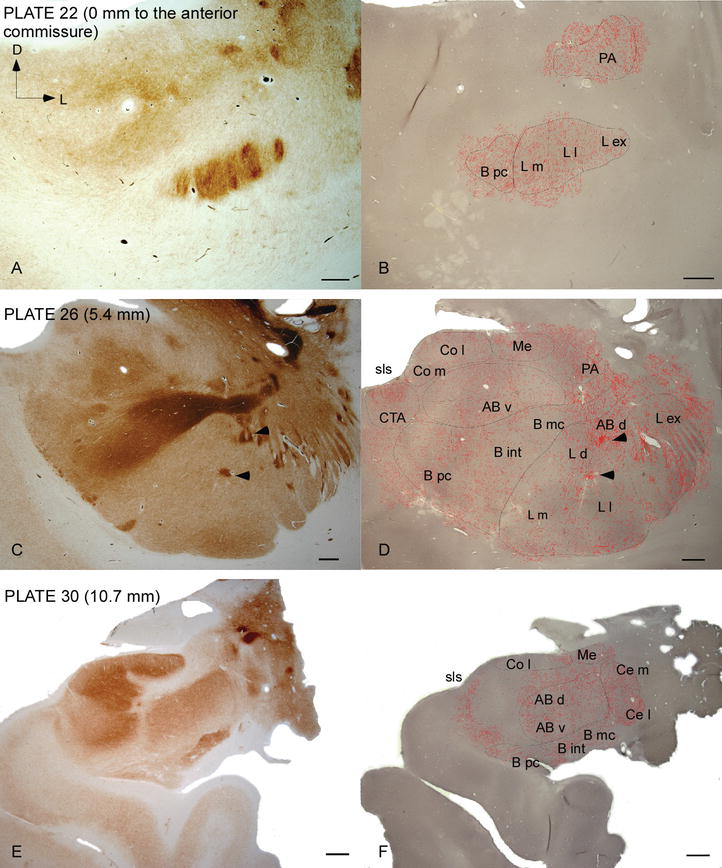
Figura 2.
distribuția fibrelor DAT‐pozitive în AC uman. Serie de două secțiuni coronale adiacente colorate pentru acetilcolinesterază (AChE) (A, C, E) și DAT (B, D, F) la trei niveluri anteroposterioare ale AC, cu plăcile corespunzătoare din Ref. . Stippling‐ul în B, D și F reprezintă axonii DAT-pozitivi desenați cu camera lucida la 20 centimetrii și suprapuși peste aceleași micrografii colorate pentru DAT. Arrowheads în C și D indică patch-uri cu fie AChE sau dat îmbogățit colorare, respectiv. Pentru abrevieri, a se vedea tabelul 1. Bară de scară: 1 mm.
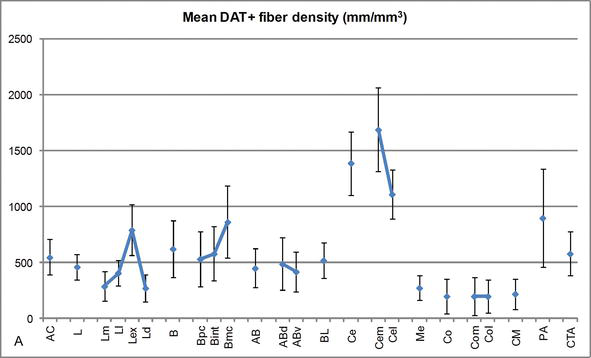
Figura 3.
densitatea lungimii fibrelor DAT‐pozitive în AC uman. Densitatea medie a lungimii fibrei dat‐pozitive pentru fiecare grup nuclear, nucleu și subdiviziune nucleară a AC. Barele de eroare reprezintă deviația standard. Pentru abrevieri, a se vedea tabelul 1. Modificat de la Garcia Oqusta – Amado și Prensa .
unul dintre cei mai izbitoare gradienți în cantitatea fibrelor DAT‐ir a avut loc de‐a lungul axei mediolaterale a nucleului lateral: lungimea totală a axonilor DAT-ir variază de la aproape 300 mm/mm3 în subdiviziunea sa mediană la aproape 800 mm/mm3 la subdiviziunea sa externă (cea mai laterală) (figurile 2 și 3). Această variație mare a cantității de fibre DAT‐ir între sectoarele medial și lateral al nucleului lateral ar putea fi legată de conexiunile lor extrinseci și intrinseci diferențiate. Astfel, nucleul lateral ar fi principala țintă a informațiilor senzoriale din lumea exterioară și trimite proiecții grele către celelalte nuclee amigdaloide . Subdiviziunea externă a nucleului lateral primește majoritatea acestor proiecții senzoriale (figurile 2 și 3), iar informațiile curg spre partea mediană a nucleului ; în plus, această regiune AC are cea mai scurtă latență a răspunsurilor condiționate provocate de stimulii senzoriali asociați cu evenimente adverse în sarcinile de învățare emoțională . Pe de altă parte, subdiviziunea mediană a nucleului lateral primește informații din zonele de procesare corticală de ordin superior . În hipocampus, axonii pozitivi dat au fost prezenți numai în cele două treimi exterioare ale stratului molecular al girusului dentat, unde se termină calea perforantă , indicând faptul că dopamina poate regla potent și selectiv intrarea din cortexul entorhinal și, astfel, etapele timpurii ale procesării hipocampului, așa cum ar putea fi cazul informațiilor senzoriale care intră în nucleul lateral AC.
nucleul central primește informații de la restul nucleelor AC și este unul dintre nucleele principale de ieșire ale AC . Proiecțiile descendente din nucleul central se termină într-o regiune mediolaterală largă a celulelor dopaminei mezencefalice . La rândul său, acest nucleu primește cea mai grea inervație dopaminergică DAT‐pozitivă a tuturor nucleelor AC, totuși inervația sa nu este distribuită uniform și scade semnificativ de‐a lungul unui gradient mediolateral, o constatare care este de acord cu modelul de distribuție al fibrelor TH-ir . În nucleele bazale bazale și accesorii ale AC, conținutul în fibrele dat-ir scade de la sectoarele dorsale la cele ventrale, deși acest gradient este mult mai puțin marcat în acesta din urmă decât în fostul nucleu (vezi figura 2a și B) .
reglarea nivelurilor extracelulare de dopamină este controlată de mecanisme distincte în diferite zone ale creierului și este probabil legată de conținutul DAT. Astfel, în timp ce striatul dorsal și nucleul accumbens prezintă o reglare „dominată de absorbție” (adică. dopamina este recapturată rapid din spațiul extracelular pentru a‐și pune capăt acțiunii), cortexul prefrontal medial și AC prezintă o reglare „dominată de eliberare” (adică dopamina este menținută în spațiul extracelular mai mult timp) ; aceste constatări sunt de acord cu observația că există mai mult DAT în striat decât în celelalte două structuri .
AC este o țintă principală pentru proiecțiile mezencefalului formate din celule din substantia nigra pars compacta (grupul dopaminergic A9), zona tegmentală ventrală (grupul dopaminergic A10) și câmpul retrorubral (grupul dopaminergic A8) . În mezencefalul uman, DAT abundă în neuroni localizați în zona tegmentală ventrală laterală și în substanța nigra pars compacta și este în mare parte absent din zona tegmentală ventrală mediană . DAT ARNm este mai abundent în nivelul ventral A9 decât în nivelul dorsal . Nucleele AC umane care conțin cele mai multe fibre DAT‐ir corespund celor care primesc proiecții puternice din mezencefalul ventral, așa cum se observă și la primate . Există, totuși, alte regiuni AC care prezintă o densitate mare de fibre DAT‐pozitive, cum ar fi subdiviziunea laterală a nucleului central, care nu par să primească inervație din nicio parte a creierului mediu ventral . Există și alte surse posibile de dopamină AC care se află în afara creierului mediu ventral, dar dacă acestea contribuie la fibrele dat‐ir întâlnite în AC sau nu, nu este încă clar. Nucleul parabrahial se proiectează către nucleele centrale și mediale ale AC și conține neuroni dopaminergici putativ care nu poartă DAT . Mai mult, neuronii nucleului parabrahial care se proiectează la AC nu au, de asemenea, tirozină hidroxilază (TH) . Substanța gri periaqueductală este o altă sursă de intrare în AC și conține neuroni dopaminergici (adică grupul A11) care conțin DAT și se proiectează către nucleele AC centrale și mediale . Această conexiune dopaminergică este relevantă, deoarece vizează în mod specific subdiviziunea laterală a nucleului central, o regiune care trimite proiecții eferente către subdiviziunea mediană a nucleului central, care la rândul său se proiectează înapoi la comportamentul de „înghețare” a manipulării substanței gri periaqueductale la animalele expuse la un stimul potențial periculos . Există , de asemenea, celule TH+ în nucleul raphe dorsal care se proiectează către nucleul AC central, dar conținutul DAT al acestor celule nu a fost încă determinat.
localizarea ultrastructurală a DAT în primatul AC este necunoscută în prezent. În cortexul cerebral, majoritatea profilurilor marcate cu DAT corespund axonilor subțiri nemielinizați care rareori formează sinapse, în timp ce profilurile marcate cu TH variază mai mult în diametru, iar varicozitățile TH‐ir conțin vezicule abundente și formează frecvent sinapse . În consecință, Lewis și colab. cred că DAT este probabil să fie limitată la segmentele intervaricose . Obiectivele postsinaptice specifice ale fibrelor dopaminergice care ajung la AC uman nu sunt cunoscute. Mai multe studii efectuate la rozătoare au demonstrat că aceste fibre produc sinapse atât cu neuroni de proiecție, cât și cu interneuroni . Deși neuronii de proiecție primesc majoritatea sinapselor dopaminergice, subseturile INTERNEURONICE CR+ și PV+ sunt, de asemenea, inervate de aceste fibre, în special cele care conțin PV . Interneuronii CR + primesc doar 6% din sinapsele dopaminergice, în timp ce celulele PV+ primesc 40%. În nucleele centrale și bazale, precum și în grupurile intercalate paracapsulare, terminalele dopaminergice formează sinapse simetrice mai frecvent decât cele asimetrice .
fibrele dopaminergice din AC formează plase perineuronale în jurul soma neuronilor de proiecție și a interneuronilor PV+ și 72% din contactele pe care aceste plase le stabilesc cu interneuronii PV+ sunt sinaptice . Aceste plase sunt abundente în aproximativ 10-15% din toate interneuronii PV+ și par să evite alte subseturi de interneuroni. Aceste plase sunt legate funcțional de inhibarea puternică observată în activitatea neuronilor de proiecție ai grupului bazolateral după eliberarea dopaminei . Inervația dopaminergică a diferitelor populații interneuronice ale AC ar putea contribui la inducerea mecanismelor de potențare pe termen lung implicate în dobândirea fricii condiționate, care necesită suprimarea inhibării Interneuronului GABAergic a neuronilor de proiecție . Dopamina inhibă interneuronii „cu ardere rapidă”, care coincid cu interneuronii PV+ și reduce inhibarea neuronilor de proiecție în nucleul amigdaloid lateral. Mai recent, Chu și colab. au demonstrat că dopamina blochează eliberarea GABA de la interneuronii PV+ la neuronii de proiecție care acționează asupra receptorilor presinaptici de tip D2, dar nu afectează eliberarea GABA la alte tipuri de interneuroni din această populație de interneuroni . Blocarea receptorilor D1 și D2 din grupul bazolateral împiedică achiziția condiționată de frică .