El Complejo Amigdaloide Humano: Arquitectura Celular e Inervación Dopaminérgica
La inervación dopaminérgica de la CA humana
El CA recibe una importante inervación dopaminérgica que se origina principalmente en los grupos mesencefálicos ventrales A8, A9 y A10, y la dopamina es un neurotransmisor clave en el CA que modula la entrada de información a través del grupo basolateral. Además, esta inervación dopaminérgica es necesaria para la adquisición, consolidación y extinción de recuerdos de miedo, así como para generar respuestas afectivas adecuadas y, como se mencionó anteriormente, las disfunciones de este sistema dopaminérgico se han propuesto como mecanismos patogénicos en enfermedades psiquiátricas como la esquizofrenia y los trastornos relacionados con el estrés . García‐Amado y Prensa recopilaron datos cuantitativos precisos sobre la cantidad de axones dopaminérgicos y su distribución en la CA de donantes humanos que no habían sido diagnosticados con enfermedades neurológicas o psiquiátricas antes de su muerte, utilizando la inmunorreactividad DAT como marcador para las fibras dopaminérgicas y los abordajes estereológicos. Dado que la inestabilidad dopaminérgica intrínseca impide su inmunodetección en el tejido cerebral que no se ha fijado rápidamente por perfusión después de la muerte del donante, estudios previos que se centraron en analizar la inervación dopaminérgica de la CA humana habían utilizado la proteína TH para detectar perfiles dopaminérgicos. Sin embargo, la proteína TH también etiqueta las fibras noradrenérgicas y adrenérgicas en la CA . Dado que el CA consta de varios grupos nucleares con una amplia gama de interconexiones con la corteza cerebral, la formación del hipocampo, los ganglios basales, el tálamo, el hipotálamo y el tronco cerebral (para revisión, ver Referencias. ), la información sobre el contenido de axones dopaminérgicos en cada uno de los grupos nucleares es necesaria para comprender mejor la organización funcional interna de este complejo.
El CA humano está dirigido por fibras DAT positivas generalizadas, que son densas y están distribuidas de manera desigual en cada subdivisión de este complejo nuclear (Figuras 2 y 3). Además, su estudio ha arrojado información precisa sobre la cantidad de fibras DAT‐ir por neurona en cada territorio amigdaloide. Como muestran estos autores, la cantidad de axones DAT‐ir en el CA humano varía entre los diversos núcleos del CA y también varía considerablemente en las diversas subdivisiones de un núcleo CA dado (Figura 2), lo que indica variaciones funcionales entre estos territorios.
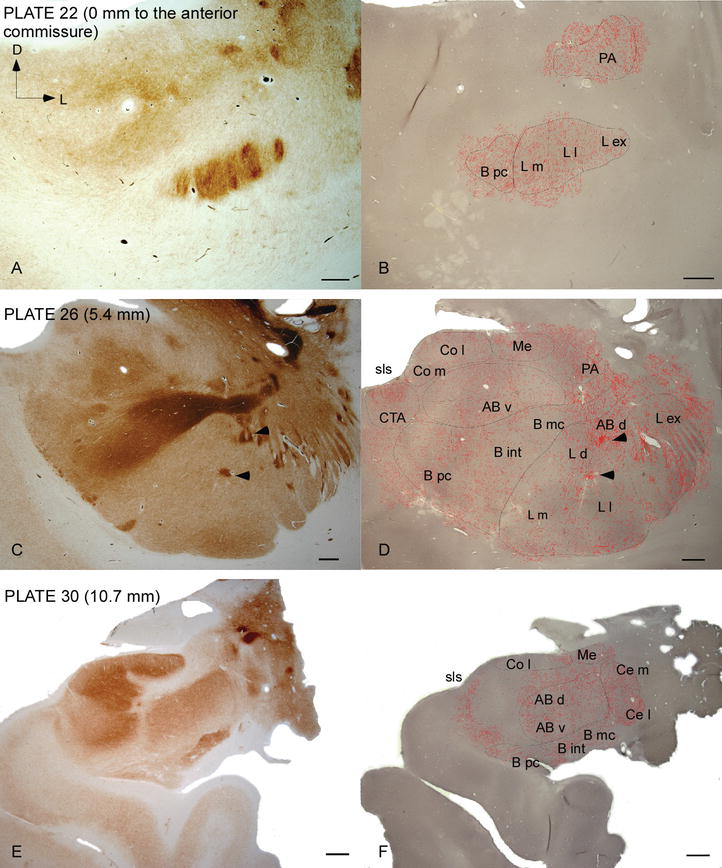
Figura 2.
Distribución de fibras DAT positivas en la CA humana. Serie de dos secciones coronales adyacentes teñidas para acetilcolinesterasa (AChE) (A, C, E) y DAT (B, D, F) en tres niveles anteroposteriores de la CA, con las placas correspondientes de la Ref. . El punteado en B, D y F representa los axones DAT positivos dibujados con cámara lúcida a 20× y superpuestos sobre las mismas micrografías teñidas para DAT. Las puntas de flecha en C y D indican parches con tinción enriquecida con dolor o DAT, respectivamente. Para las abreviaturas, véase el cuadro 1. Barra de escala: 1 mm.
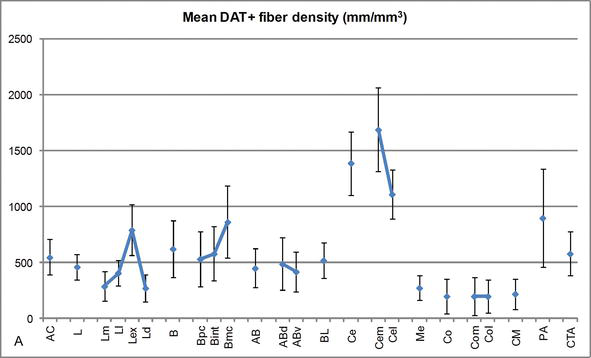
Gráfico 3
Densidad de longitud de fibras DAT positivas en la CA humana. Densidad media de longitud de fibra DAT positiva para cada grupo nuclear, núcleo y subdivisión nuclear del CA. Las barras de error representan la desviación estándar. Para las abreviaturas, véase el cuadro 1. Modificado de García-Amado y Prensa .
Uno de los gradientes más llamativos en la cantidad de fibras DAT‐ir ocurrió a lo largo del eje mediolateral del núcleo lateral: la longitud total de los axones DAT‐ir varía de casi 300 mm/mm3 en su subdivisión medial a casi 800 mm/mm3 en su subdivisión externa (más lateral) (Figuras 2 y 3). Esta gran variación en la cantidad de fibras DAT‐ir entre los sectores medial y lateral del núcleo lateral podría estar relacionada con sus conexiones extrínsecas e intrínsecas diferenciadas. Por lo tanto, el núcleo lateral sería el objetivo principal de la información sensorial del mundo externo, y envía proyecciones pesadas a los otros núcleos amigdaloides . La subdivisión externa del núcleo lateral recibe la mayoría de estas proyecciones sensoriales (Figuras 2 y 3), y la información fluye hacia el lado medial del núcleo ; además, esta región AC tiene la latencia más corta de respuestas condicionadas provocadas por estímulos sensoriales asociados con eventos adversos en tareas de aprendizaje emocional . Por otro lado, la subdivisión medial del núcleo lateral recibe información de áreas de procesamiento corticales de orden superior . En el hipocampo, los axones DAT positivos estaban presentes solo en los dos tercios exteriores de la capa molecular del giro dentado, donde termina la vía perforante , lo que indica que la dopamina puede regular de manera potente y selectiva la entrada de la corteza entorrinal y, por lo tanto, las primeras etapas del procesamiento del hipocampo, como podría ser el caso de la información sensorial que ingresa al núcleo lateral AC.
El núcleo central recibe información del resto de los núcleos de CA y es uno de los principales núcleos de salida del CA . Las proyecciones descendentes del núcleo central terminan en una amplia región mediolateral de células mesencefálicas de dopamina . A su vez, este núcleo recibe la mayor inervación dopaminérgica DAT positiva de todos los núcleos AC, sin embargo, su inervación no está distribuida de manera uniforme y disminuye marcadamente a lo largo de un gradiente mediolateral, un hallazgo que concuerda con el patrón de distribución de las fibras TH‐ir . En los núcleos basales y basales accesorios de la CA, el contenido en fibras DAT‐ir disminuye de los sectores dorsal a ventral, aunque este gradiente es mucho menos marcado en este último que en el núcleo anterior (ver Figura 2A y B) .
La regulación de los niveles de dopamina extracelular está controlada por distintos mecanismos en diferentes áreas cerebrales y probablemente está relacionada con el contenido de DAT. Por lo tanto, mientras que el cuerpo estriado dorsal y el núcleo accumbens muestran una regulación «dominada por la captación» (i. e. una en la que la dopamina se recaptura rápidamente del espacio extracelular para terminar con su acción), la corteza prefrontal medial y la CA muestran una regulación «dominada por la liberación» (es decir, la dopamina se mantiene en el espacio extracelular más tiempo) ; estos hallazgos concuerdan con la observación de que hay más DAT en el cuerpo estriado que en las otras dos estructuras .
La CA es un objetivo principal para las proyecciones mesencefálicas compuestas por células de la sustancia negra pars compacta (grupo dopaminérgico A9), el área tegmental ventral (grupo dopaminérgico A10) y el campo retrorubral (grupo dopaminérgico A8) . En el mesencéfalo humano, el DAT abunda en neuronas localizadas en el área tegmental ventral lateral y en la sustancia negra compacta y está ausente en gran medida del área tegmental ventral medial . El ARNm DAT es más abundante en el nivel ventral A9 que en el nivel dorsal . Los núcleos de CA humanos que contienen la mayor cantidad de fibras DAT‐ir corresponden a aquellos que reciben fuertes proyecciones del mesencéfalo ventral, como también se observa en primates . Hay, sin embargo, otras regiones AC que muestran una alta densidad de fibras DAT positivas, como la subdivisión lateral del núcleo central, que no parecen recibir inervación de ninguna parte del mesencéfalo ventral . Hay otras posibles fuentes de dopamina AC que se encuentran fuera del mesencéfalo ventral, pero aún no está claro si contribuyen a las fibras DAT‐ir encontradas en la CA o no. El núcleo parabraquial se proyecta a los núcleos central y medial de la CA y contiene neuronas supuestamente dopaminérgicas que no transportan DAT . Además, las neuronas del núcleo parabraquial que se proyectan hacia la CA también carecen de tirosina hidroxilasa (TH) . La sustancia gris periacueductal es otra fuente de entrada a la CA y contiene neuronas dopaminérgicas (es decir, el grupo A11) que contienen DAT y se proyectan a los núcleos central y medial de la CA . Esta conexión dopaminérgica es relevante, ya que se dirige específicamente a la subdivisión lateral del núcleo central, una región que envía proyecciones eferentes a la subdivisión medial del núcleo central, que a su vez se proyecta de nuevo al comportamiento de «congelación» de manejo de sustancias grises periacueductales en animales expuestos a un estímulo potencialmente peligroso . También hay células TH+ en el núcleo del rafe dorsal que se proyectan hacia el núcleo central AC, pero el contenido de DAT de estas células aún no se ha determinado.
La localización ultraestructural de DAT en el primate AC es desconocida en la actualidad. En la corteza cerebral, la mayoría de los perfiles marcados con DAT corresponden a axones delgados no mielinizados que rara vez forman sinapsis, mientras que los perfiles marcados con TH varían más en su diámetro y las varicosidades IR‐TH contienen vesículas abundantes y con frecuencia forman sinapsis . En consecuencia, Lewis et al. cree que es probable que el DAT se restrinja a los segmentos intervaricosos . No se conocen las dianas postsinápticas específicas de las fibras dopaminérgicas que llegan a la CA humana. Varios estudios en roedores han demostrado que estas fibras producen sinapsis con neuronas de proyección e interneuronas . Aunque las neuronas de proyección reciben la mayoría de las sinapsis dopaminérgicas , los subconjuntos de interneuronas CR+ y PV+ también están inervados por estas fibras, especialmente las que contienen PV . Las interneuronas CR + reciben solo el 6% de las sinapsis dopaminérgicas, mientras que las células PV+ reciben el 40%. En los núcleos central y basal, así como en los grupos intercalados paracapsulares, los terminales dopaminérgicos forman sinapsis simétricas con mayor frecuencia que las asimétricas .
Fibras dopaminérgicas en la forma AC redes perineuronales alrededor del soma de las neuronas de proyección y las interneuronas PV+, y el 72% de los contactos que estas redes establecen con las interneuronas PV+ son sinápticos . Estas redes son abundantes en alrededor del 10-15% de todas las interneuronas PV+ y parecen evitar otros subconjuntos de interneuronas. Estos tne están relacionados funcionalmente con la fuerte inhibición observada en la actividad de las neuronas de proyección del grupo basolateral después de la liberación de dopamina . La inervación dopaminérgica de las diversas poblaciones de interneurona de la CA podría contribuir a la inducción de mecanismos de potenciación a largo plazo involucrados en la adquisición de miedo condicionado, lo que requiere la supresión de la inhibición de interneurona gabaérgica de las neuronas de proyección . La dopamina inhibe las interneuronas de «disparo rápido», que coinciden con las interneuronas PV+, y reduce la inhibición de las neuronas de proyección en el núcleo amigdaloide lateral. Más recientemente, Chu et al. han demostrado que la dopamina bloquea la liberación de GABA de las interneuronas PV + a las neuronas de proyección que actúan sobre los receptores presinápticos tipo D2, pero no afecta la liberación de GABA a otros tipos de interneuronas de esta población de interneuronas . El bloqueo de los receptores D1 y D2 en el grupo basolateral previene la adquisición condicionada por el miedo .