Le Complexe Amygdaloïde Humain : Architecture cellulaire et Innervation Dopaminergique
L’innervation dopaminergique de l’AC humain
L’AC reçoit une innervation dopaminergique substantielle provenant principalement des groupes mésencéphaliques ventraux A8, A9 et A10 et la dopamine est un neurotransmetteur clé dans l’AC qui module l’entrée d’informations à travers le groupe basolatéral. De plus, cette innervation dopaminergique est nécessaire à l’acquisition, à la consolidation et à l’extinction des souvenirs de peur ainsi qu’à la génération de réponses affectives appropriées et, comme mentionné précédemment, des dysfonctionnements de ce système dopaminergique ont été proposés comme mécanismes pathogènes dans des maladies psychiatriques telles que la schizophrénie et les troubles liés au stress. Des données quantitatives précises concernant la quantité d’axones dopaminergiques et leur distribution dans le CA provenant de donneurs humains qui n’avaient pas reçu de diagnostic de maladies neurologiques ou psychiatriques avant leur mort ont été collectées par García‐Amado et Prensa en utilisant l’immunoréactivité DAT comme marqueur des fibres dopaminergiques et des approches stéréologiques. Étant donné que l’instabilité intrinsèque de la dopamine empêche son immunodétection dans le tissu cérébral qui n’a pas été rapidement fixé par perfusion après la mort du donneur, des études antérieures axées sur l’analyse de l’innervation dopaminergique de l’AC humain avaient utilisé la protéine TH pour détecter les profils dopaminergiques. Cependant, la protéine TH marque également les fibres noradrénergiques et adrénergiques dans le CA. Étant donné que l’AC se compose de plusieurs groupes nucléaires avec une vaste gamme d’interconnexions avec le cortex cérébral, la formation de l’hippocampe, les ganglions de la base, le thalamus, l’hypothalamus et le tronc cérébral (pour examen, voir Refs. ), des informations sur le contenu des axones dopaminergiques dans chacun des groupes nucléaires sont nécessaires pour mieux comprendre l’organisation fonctionnelle interne de ce complexe.
L’AC humain est ciblé par des fibres DAT‐positives répandues, qui sont denses et inégalement réparties dans toutes les subdivisions de ce complexe nucléaire (Figures 2 et 3). De plus, leur étude a fourni des informations précises sur la quantité de fibres DAT-ir par neurone dans chaque territoire amygdaloïde. Comme le montrent ces auteurs, la quantité d’axones DAT-ir dans l’AC humain varie entre les différents noyaux de l’AC et varie également considérablement dans les différentes subdivisions d’un noyau AC donné (Figure 2), indiquant des variations fonctionnelles entre ces territoires.
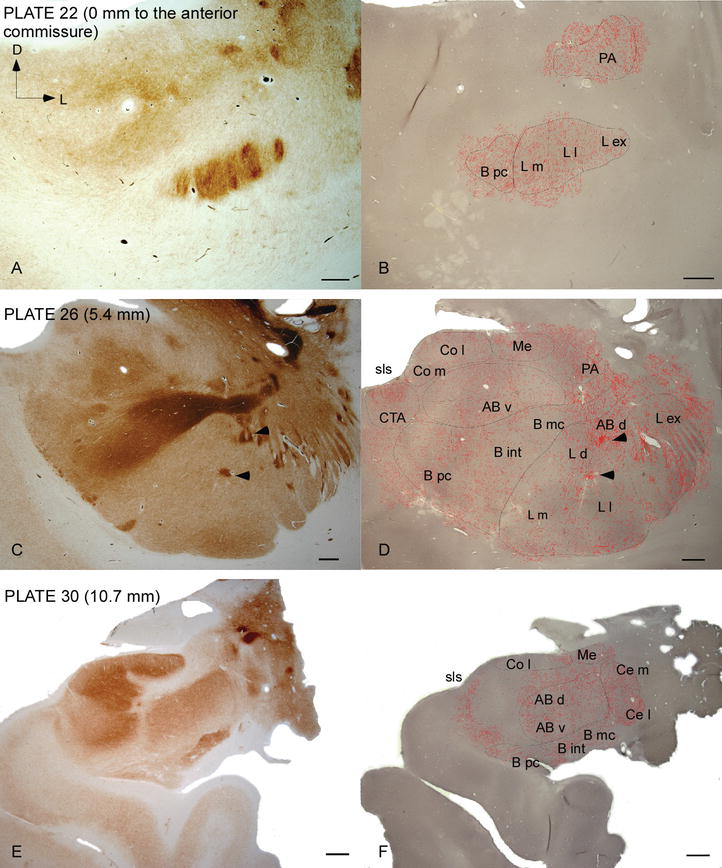
Figure 2.
Distribution des fibres positives au DAT dans l’AC humain. Série de deux coupes coronales adjacentes colorées pour l’acétylcholinestérase (AChE) (A, C, E) et le DAT (B, D, F) à trois niveaux antéropostérieurs de l’AC, avec les plaques correspondantes de Ref. . Le pointillé en B, D et F représente les axones DAT‐positifs dessinés avec camera lucida à 20× et superposés sur les mêmes micrographies colorées pour DAT. Les pointes de flèches en C et en D indiquent des taches avec une coloration enrichie de douleur ou de DAT, respectivement. Pour les abréviations, voir le tableau 1. Barre d’échelle: 1 mm.
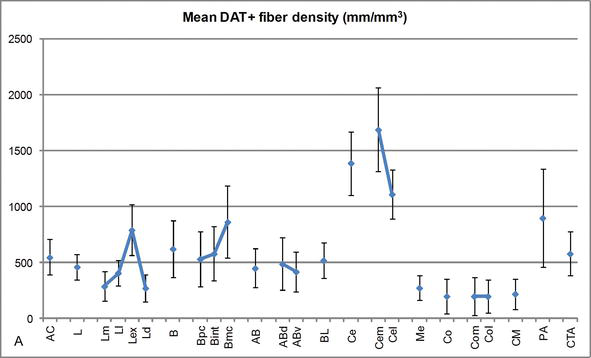
Figure 3.
Densité de longueur des fibres positives au DAT dans l’AC humain. Densité moyenne de longueur de fibre DAT positive pour chaque groupe nucléaire, noyau et subdivision nucléaire de l’AC. Les barres d’erreur représentent l’écart type. Pour les abréviations, voir le tableau 1. Modifié à partir de García-Amado et Prensa.
L’un des gradients les plus frappants dans la quantité de fibres DAT‐ir s’est produit le long de l’axe médiolatéral du noyau latéral: la longueur totale des axones DAT‐ir varie de près de 300 mm / mm3 dans sa subdivision médiale à près de 800 mm / mm3 dans sa subdivision externe (la plus latérale) (Figures 2 et 3). Cette grande variation de la quantité de fibres DAT-ir entre les secteurs médial et latéral du noyau latéral pourrait être liée à leurs connexions extrinsèques et intrinsèques différenciées. Ainsi, le noyau latéral serait la cible principale des informations sensorielles du monde extérieur, et il envoie de lourdes projections aux autres noyaux amygdaloïdes. La subdivision externe du noyau latéral reçoit la plupart de ces projections sensorielles (Figures 2 et 3), et l’information circule vers le côté médial du noyau; de plus, cette région AC présente la latence la plus courte des réponses conditionnées provoquées par des stimuli sensoriels associés à des événements indésirables dans des tâches d’apprentissage émotionnel. D’autre part, la subdivision médiale du noyau latéral reçoit des informations provenant de zones de traitement cortical d’ordre supérieur. Dans l’hippocampe, les axones DAT positifs n’étaient présents que dans les deux tiers externes de la couche moléculaire du gyrus denté, où se termine la voie perforante, indiquant que la dopamine peut réguler de manière puissante et sélective l’entrée du cortex entorhinal et donc les premiers stades du traitement de l’hippocampe, comme cela pourrait être le cas pour les informations sensorielles entrant dans le noyau latéral AC.
Le noyau central reçoit des informations du reste des noyaux AC et est l’un des principaux noyaux de sortie de l’AC. Les projections descendantes du noyau central se terminent par une large région médiolatérale des cellules dopaminergiques mésencéphaliques. À son tour, ce noyau reçoit l’innervation dopaminergique DAT‐positive la plus lourde de tous les noyaux AC, mais son innervation n’est pas uniformément répartie et diminue nettement le long d’un gradient médiolatéral, une constatation qui concorde avec le schéma de distribution des fibres TH‐ir. Dans les noyaux basaux et accessoires de l’AC, la teneur en fibres DAT‐ir diminue du secteur dorsal au secteur ventral, bien que ce gradient soit beaucoup moins marqué dans ce dernier que dans le premier noyau (voir Figure 2A et B).
La régulation des niveaux de dopamine extracellulaire est contrôlée par des mécanismes distincts dans différentes zones du cerveau et est probablement liée au contenu en DAT. Ainsi, alors que le striatum dorsal et le noyau accumbens présentent une régulation » dominée par l’absorption » (i.e. un dans lequel la dopamine est rapidement récupérée de l’espace extracellulaire pour mettre fin à son action), le cortex préfrontal médial et l’AC montrent une régulation « dominée par la libération » (c’est‐à-dire que la dopamine est maintenue dans l’espace extracellulaire plus de temps); ces résultats sont en accord avec l’observation qu’il y a plus de DAT dans le striatum que dans les deux autres structures.
L’AC est une cible principale pour les projections mésencéphales composées de cellules de la substantia nigra pars compacta (groupe dopaminergique A9), de la zone tegmentale ventrale (groupe dopaminergique A10) et du champ rétrorubral (groupe dopaminergique A8). Chez le mésencéphale humain, le DAT abonde en neurones situés dans la région tegmentale ventrale latérale et dans la substantia nigra pars compacta et est largement absent de la région tegmentale ventrale médiale. L’ARNM DAT est plus abondant dans le niveau ventral A9 que dans le niveau dorsal. Les noyaux AC humains qui contiennent le plus de fibres DAT‐ir correspondent à ceux qui reçoivent de fortes projections du mésencéphale ventral, comme on l’observe également chez les primates. Il existe néanmoins d’autres régions AC présentant une densité élevée de fibres positives au DAT, telles que la subdivision latérale du noyau central, qui ne semblent recevoir d’innervation d’aucune partie du mésencéphale ventral. Il existe d’autres sources possibles de dopamine AC situées en dehors du mésencéphale ventral, mais on ne sait pas encore si elles contribuent aux fibres DAT‐ir rencontrées dans le CA ou non. Le noyau parabrachial se projette sur les noyaux centraux et médiaux de l’AC et il contient des neurones dopaminergiques qui ne portent pas de DAT. De plus, les neurones du noyau parabrachial qui se projettent vers l’AC manquent également de tyrosine hydroxylase (TH). La substance grise périaquéductale est une autre source d’entrée dans l’AC et elle contient des neurones dopaminergiques (c’est-à-dire le groupe A11) qui contiennent du DAT et se projettent vers les noyaux AC centraux et médiaux. Cette connexion dopaminergique est pertinente car elle cible spécifiquement la subdivision latérale du noyau central, une région qui envoie des projections efférentes à la subdivision médiale du noyau central, qui à son tour renvoie à la substance grise périaquéductale manipulant un comportement de « congélation » chez les animaux exposés à un stimulus potentiellement dangereux. Il existe également des cellules TH+ dans le noyau du raphé dorsal qui se projettent vers le noyau AC central, mais la teneur en DAT de ces cellules n’a pas encore été déterminée.
La localisation ultrastructurale du DAT chez le primate AC est inconnue à l’heure actuelle. Dans le cortex cérébral, la plupart des profils marqués DAT correspondent à de minces axones non myélinisés qui forment rarement des synapses, alors que les profils marqués TH varient davantage en diamètre et que les varicosités TH‐ir contiennent des vésicules abondantes et forment fréquemment des synapses. Par conséquent, Lewis et coll. croyez que le DAT est susceptible d’être limité aux segments intervariques. Les cibles postsynaptiques spécifiques des fibres dopaminergiques qui atteignent l’AC humain ne sont pas connues. Plusieurs études chez les rongeurs ont démontré que ces fibres forment des synapses avec les neurones de projection et les interneurones. Bien que les neurones de projection reçoivent la majorité des synapses dopaminergiques, les sous-ensembles d’interneurones CR+ et PV+ sont également innervés par ces fibres, en particulier celles contenant du PV. Les interneurones CR+ ne reçoivent que 6% des synapses dopaminergiques, tandis que les cellules PV+ en reçoivent 40%. Dans les noyaux centraux et basaux, ainsi que dans les groupes intercalés paracapsulaires, les terminaux dopaminergiques forment plus fréquemment des synapses symétriques que des synapses asymétriques.
Les fibres dopaminergiques en AC forment des réseaux périneuronaux autour du soma des neurones de projection et des interneurones PV+, et 72% des contacts que ces réseaux établissent avec les interneurones PV+ sont synaptiques. Ces filets sont abondants dans environ 10 à 15% de tous les interneurones PV+ et ils semblent éviter d’autres sous-ensembles d’interneurones. Ces réseaux sont fonctionnellement liés à la forte inhibition observée dans l’activité des neurones de projection du groupe basolatéral après la libération de dopamine. L’innervation dopaminergique des différentes populations d’interneurones de l’AC pourrait contribuer à l’induction de mécanismes de potentialisation à long terme impliqués dans l’acquisition de la peur conditionnée, ce qui nécessite la suppression de l’inhibition des interneurones GABAergiques des neurones de projection. La dopamine inhibe les interneurones « à tir rapide », qui coïncident avec les interneurones PV +, et réduit l’inhibition des neurones de projection dans le noyau amygdaloïde latéral. Plus récemment, Chu et al. ont démontré que la dopamine bloque la libération de GABA des interneurones PV + vers les neurones de projection agissant sur les récepteurs présynaptiques de type D2, mais cela n’affecte pas la libération de GABA vers d’autres types d’interneurones de cette population d’interneurones. Le blocage des récepteurs D1 et D2 dans le groupe basolatéral empêche l’acquisition conditionnée par la peur.