ヒト扁桃体複合体:細胞アーキテクチャとドーパミン作動性神経支配
ヒトAcのドーパミン作動性神経支配
ACはa8、A9およびa10腹側中脳グループから主に起きる相当なドーパミン作動性神経支配を受け取り、ドーパミンはbasolateralグループを通した情報の記入項目を調整するACの主神経伝達物質である。 さらに、このドーパミン作動性神経支配は、恐怖記憶の獲得、統合および消滅、ならびに適切な情動応答を生成するために必要であり、前述のように、このドパミン作動性システムの機能不全は、統合失調症およびストレス関連障害などの精神疾患における病原性メカニズムとして提案されている。 死の前に神経学的または精神医学的疾患と診断されていなかったヒトドナーからのドーパミン作動性軸索の量とAC中のそれらの分布に関する正確な定量的データは、ドーパミン作動性繊維および立体学的アプローチのマーカーとしてDAT免疫反応性を用いてGarcía‐AmadoとPrensaによって収集された。 内因性ドーパミン不安定性は、ドナーの死の後に灌流によって急速に固定されていない脳組織におけるその免疫検出を防止するので、ヒトACのドーパミン作動性神経支配の分析に焦点を当てた以前の研究は、ドーパミン作動性プロファイルを検出するためにTHタンパク質を使用していた。 ただし、TH蛋白質はまたACのnoradrenergicおよびadrenergic繊維を分類します。 ACは、大脳皮質、海馬形成、大脳基底核、視床、視床下部、および脳幹との相互接続の広大な配列を有するいくつかの核群からなるので(レビューは参考文献を参 この複合体の内部機能組織をよりよく理解するためには、核群のそれぞれにおけるドーパミン作動性軸索の含有量に関する情報が必要である。
ヒトACは、この核複合体のすべての細分に密集して不均一に分布する広範なDAT陽性繊維によって標的とされている(図2および3)。 さらに、彼らの研究は、各扁桃体領域におけるニューロンあたりのDAT‐ir線維の量に関する正確な情報をもたらした。 これらの著者によって示されるように、ヒトACにおけるDAT‐ir軸索の量は、ACのいくつかの核の間で変化し、また、与えられたAC核の様々な細分化でかなり変化し(図2)、これらの領域間の機能的変化を示している。
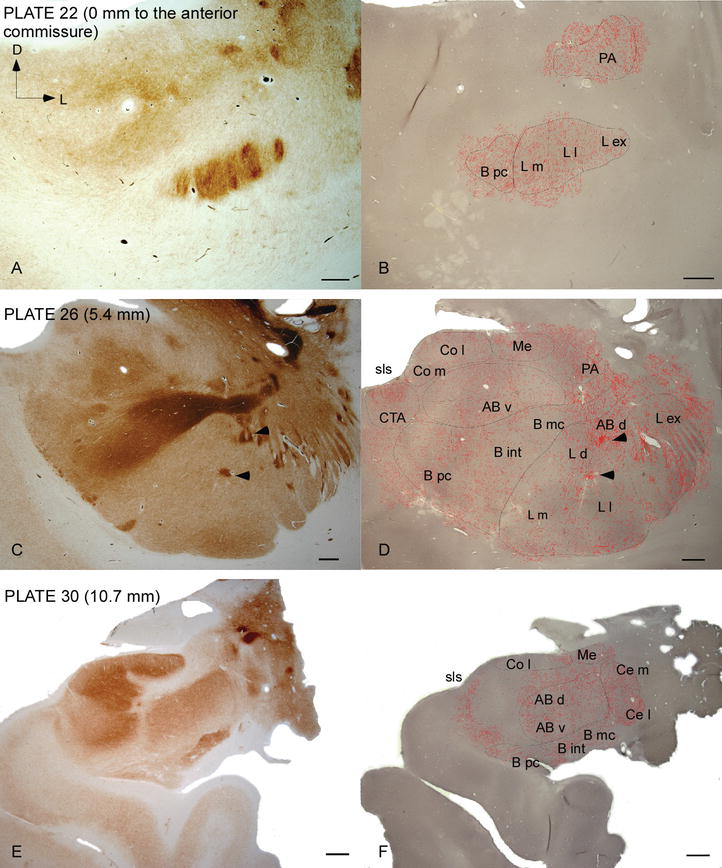
図2.
ヒトACにおけるDAT陽性繊維の分布。 アセチルコリンエステラーゼ(Ache)(A,C,E)およびDAT(B,D,F)について,ACの三つの前後レベルで染色された二つの隣接する冠状切片のシリーズで,対応するプレートを参照した。 . B、DおよびFの点描は、camera lucidaで20×で描かれ、DATのために染色された同じ顕微鏡写真に重畳されたDAT陽性軸索を表す。 CおよびDの矢頭は、それぞれAChEまたはDAT濃縮染色のいずれかを有するパッチを示す。 略語については、表1を参照してください。 スケールバー:1mm.
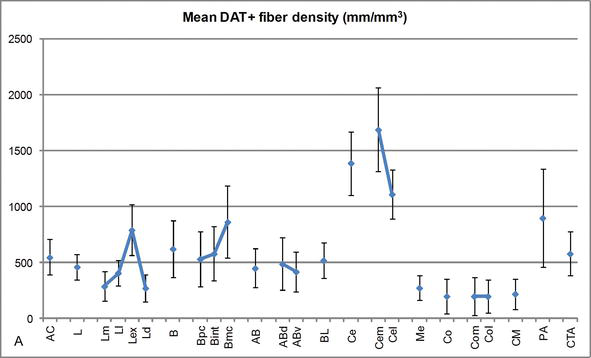
図3.
ヒトACにおけるDAT陽性繊維の長さ密度。 平均DAT‐ACのすべての核グループ、核および核細分の正の繊維長密度。 誤差バーは標準偏差を表します。 略語については、表1を参照してください。 ガルシア‐アマドとプレンサから変更されました。
DAT‐ir繊維の量の最も顕著な勾配の一つは、側核の中外側軸に沿って発生した:DAT‐ir軸索の全長は、その内側の細分でほぼ300mm/mm3から、その外部(最も側方)細分でほぼ800mm/mm3の範囲である(図2および3)。 側核の内側と外側のセクター間のDAT‐ir繊維の量のこの大きな変化は、それらの分化した外因性および内因性の接続に関連している可能性がある。 したがって、外側核は外界からの感覚情報の主な標的であり、他の扁桃体核に重い突起を送る。 側核の外部細分は、これらの感覚投影のほとんどを受け取り(図2および3)、情報は核の内側に向かって流れます。 一方、外側核の内側の細分は、高次の皮質処理領域から情報を受け取る。 海馬では,dat陽性軸索は歯状回の分子層の外側三分の二にのみ存在し,穿孔経路が終了し,ドーパミンが内側皮質からの入力を強力かつ選択的に調節し,海馬処理の初期段階を調節することを示した。
中心核は残りの交流核から情報を受け取り、交流の主な出力核の一つである。 中央核からの下降突起は、中脳ドーパミン細胞の広い中外側領域で終了する。 次に、この核はすべてのAC核の最も重いDAT陽性ドーパミン作動性神経支配を受けるが、その神経支配は均一に分布しておらず、中外側勾配に沿って著しく減少し、TH‐ir繊維の分布パターンと一致する知見である。 ACの基底核および副基底核では、DAT‐ir線維の含有量は背側から腹側のセクターに減少するが、この勾配は前者の核よりも後者の方がはるかに少ない(図2A
細胞外ドーパミンレベルの調節は、異なる脳領域における異なるメカニズムによって制御され、おそらくDAT含有量に関連している。 したがって、背側線条体および側坐核は、”取り込み支配”調節を示すのに対し(すなわち ドーパミンが細胞外空間から迅速に回収されて作用を終了する)、内側前頭前野およびACは”放出支配”調節を示す(すなわち、ドーパミンは細胞外空間により多くの時間を維持する)。
ACは、黒質のcompacta(A9ドーパミン作動性グループ)、腹側被蓋領域(A10ドーパミン作動性グループ)、およびretrorubralフィールド(A8ドーパミン作動性グループ)からの細胞で構成される中脳突起の主な標的である。 ヒト中脳では,DATは外側腹側被蓋領域と黒質部compactaに位置するニューロンに富み,内側腹側被蓋領域にはほとんど存在しない。 DAT mRNAは、背側層よりもa9腹側層でより豊富である。 最も多くのDAT‐ir線維を含むヒトAC核は、霊長類でも観察されるように、腹側中脳から強い突起を受けるものに対応する。 それにもかかわらず、腹側中脳のどの部分からも神経支配を受けていないように見える中心核の外側細分のような、DAT陽性繊維の高密度を示す他の 腹側中脳の外側にあるACドーパミンの他の可能性のある供給源があるが、それらがACで遭遇するDAT‐ir線維に寄与するかどうかはまだ明らかではない。 Parabrachial核はACの中央および中間の核に写し出し、DATを運ばないputativelyドーパミン作動性ニューロンを含んでいます。 さらに、ACに投射する傍核のニューロンはまたチロシンのヒドロキシラーゼ(TH)を欠いています。 中水道周囲灰色物質はACへの別の入力源であり、DATを含み、中央および内側のAC核に投射するドーパミン作動性ニューロン(すなわちA11グループ)を含む。 このドーパミン作動性の接続は、特に中央核の外側の細分化、潜在的に危険な刺激にさらされた動物の”凍結”行動を扱う中水管周囲の灰色の物質に戻って投影する中央核の内側の細分化に遠心突起を送信する領域をターゲットとするため、関連している。 また、中央のAC核に投射する背側raphe核にTH+細胞があるが、これらの細胞のDAT含有量はまだ決定されていない。
霊長類ACにおけるDATの超微細構造的局在は現時点では不明である。 大脳皮質では、DAT標識されたプロファイルのほとんどは、TH標識されたプロファイルは、その直径がより変化し、TH‐ir varicositiesは豊富な小胞を含み、頻繁にシナプス その結果、Lewis e t a l. DATは間隔セグメントに制限される可能性が高いと考えています。 ヒトACに到達するドーパミン作動性繊維の特定のシナプス後標的は知られていない。 げっ歯類におけるいくつかの研究は、これらの繊維が投射ニューロンと介在ニューロンの両方とシナプスを作ることを実証している。 投射ニューロンはドーパミン作動性シナプスの大部分を受け取るが、CR+およびPV+介在ニューロンサブセットはまた、これらの繊維、特にPVを含むものによって神経支配される。 CR+介在ニューロンはドーパミン作動性シナプスの6%だけを受け取りますが、PV+細胞は40%を受け取ります。 中心核および基底核および傍嚢間群において、ドーパミン作動性末端は非対称シナプスよりも頻繁に対称シナプスを形成する。
ACのドーパミン作動性繊維は、投射ニューロンとPV+介在ニューロンの相馬の周りに神経周囲ネットを形成し、これらのネットがPV+介在ニューロンと確立する これらのネットは、すべてのPV+介在ニューロンのいくつかの10-15%に豊富であり、彼らは他の介在ニューロンサブセットを避けるために表示されます。 これらのネットは、ドーパミン放出後の基底外側群の投射ニューロンの活性において観察される強い阻害と機能的に関連している。 ACの様々な介在ニューロン集団のドーパミン作動性神経支配は、投影ニューロンのGaba作動性介在ニューロン阻害の抑制を必要とする条件付き恐怖獲得に関与 ドーパミンは、PV+介在ニューロンと一致する”高速発射”介在ニューロンを阻害し、側扁桃体核における投射ニューロンの阻害を減少させる。 より最近では、Chu e t a l. d2型シナプス前受容体に作用する投射ニューロンへのpv+介在ニューロンからのドーパミンブロックGABA放出が、この介在ニューロン集団からの他の介在ニューロンタイプへのGABAの放出には影響しないことを実証している。 基底外側群におけるD1受容体およびD2受容体の両方の遮断は、恐怖条件付き獲得を防止する。