Profylaxe stresových vředů: důsledky nadužívání a zneužití
US Pharm. 2011;36(10):73-76.
zdá se, jako by téměř každý pacient přijat do nemocnice ve Spojených Státech je předepsán buď inhibitor protonové pumpy (PPI) nebo histamin-2 antagonisty (H2A) jako stres vřed profylaxe (SUP). Stresové vředy jsou eroze žaludeční sliznice, které se mohou vyvinout u pacientů se závažným onemocněním nebo těžkým zraněním. Na rozdíl od peptických vředů, které mají tendenci se vyvíjet v antru nebo dvanáctníku, se slizniční poranění související se stresem obvykle vyskytují v oblastech žaludku produkujících kyselinu (tj.1 stresové vředy, na rozdíl od peptických vředů, mají tendenci způsobovat gastrointestinální (GI) krvácení a nejsou spojeny s bolestí břicha. Slizniční změny související se stresem sliznice především malé eroze, které nevedou ke krvácení, ale může se vyvinout do hlubší vředy, které způsobují krvácení.
k tvorbě stresových vředů přispívá několik faktorů, včetně hypersekrece kyselin; změna normálních ochranných mechanismů, jako jsou sekrece hlenu a bikarbonátu; uvolňování mediátorů, jako jsou metabolity kyseliny arachidonové, cytokiny a volné radikály kyslíku; a ischemie do systému GI.2 Tyto eroze se mohou objevit rychle (£24 hodin přijetí) nebo se mohou vyvinout déle (>10-14 dní).2 stresové vředy a související krvácení způsobují významnou morbiditu a mortalitu u kriticky nemocných pacientů. Jedna studie uváděla úmrtnost 46% u kriticky nemocných pacientů s krvácením GI ve srovnání s 21% u pacientů bez krvácení (P <.001).3 další studie potvrdily tuto vysokou úmrtnost.4,5
velké studie ukázaly, že nejsilnějšími rizikovými faktory pro krvácení GI související se stresem jsou prodloužená mechanická ventilace a koagulopatie.4 riziko se zvyšuje s rostoucím počtem dní mechanické ventilace a délkou pobytu na JIP.6 Mezi další rizikové faktory patří nedávná velká operace, velké trauma, těžké popáleniny, trauma hlavy, onemocnění jater nebo ledvin při přijetí, sepse a hypotenze.1 tabulka 1 poskytuje úplný seznam rizikových faktorů.

Profylaktické Terapie
i když ukázala být vysoce efektivní při snižování rizika explicitních a klinicky důležité stresu slizniční krvácení, profylaktické terapie sama o sobě neznamená snížení celkové úmrtnosti.7 přesto je předepisování PPI nebo H2As jako SUP podporováno literaturou a pokyny pro populaci kritické péče. V posledních letech se používání SUP u pacientů bez JIP-často bez indikace—zvýšilo. Více studií prokázalo nadužívání léků potlačujících kyselinu (ASD); až 71% přijatých pacientů je předepsáno ASDs, přičemž mnoho z nich je chybně propuštěno těmito látkami.8 mnoho pacientů je v komunitě nevhodně předepsáno ASD a během hospitalizace se dělá jen málo pro přerušení těchto léků. Navíc, pacienti na dvakrát denně PPI dávkování k léčbě refluxní choroba jícnu (GERD) příznaky často nejsou odstoupil, aby se single-denní dávky terapie, jakmile jsou asymptomatické.9
nadužívání a zneužití ASD může vést k poškození pacienta a zvýšeným nákladům na systém zdravotní péče. Počet potřebný k léčbě (NNT), aby se zabránilo jeden díl klinicky významné krvácení v JIP přesahuje 900; NNT není známo v non-JIP, ale očekává se, že bude mnohem vyšší.9 V retrospektivní kohortní studii v akademickém nemocnice, lůžková náklady na SUP v non-JIP byly 44000 dolarů ročně a ambulantní lékárna náklady byly téměř $68,000 když drogy byly i nadále postdischarge, kombinované roční odhadované výdaje ve výši téměř $112,000.10 To by mohlo snadno zabránit.
s ohledem na tyto statistiky je SUP nadále předepsán. V průřezovém Web-based průzkum hodnocení lékařů znalostí, přesvědčení a chování, pokud jde o předepisování SUP v non-ICU pacientů, obavy o GI krvácení a právní důsledky předepisuje SUP byly spojeny s vyšší předepisování úrovni, vzhledem k tomu, že znalosti SUP označení a obavy o nežádoucí účinky byly spojeny s nízkými předepisování chování.11 méně než polovina lékařů mohla identifikovat jediný vedlejší účinek léčby PPI.11 Mnoho praktiků zobrazit tyto drogy jako neškodné, ale studie naznačují, že PPI a H2A terapie je silně spojena s větší pravděpodobností se o infekci Clostridium difficile (CDI) a zvýšení výskytu recidivy.12,13 Další často přehlížena rizika spojená s tímto terapie patří hypomagnezémie; vitamin B12; infekce horních cest dýchacích, včetně pneumonie získané v komunitě (CAP) a nemocniční pneumonie (HAP); zlomenin kyčle, páteře a zápěstí, a změnil absorpce závislá na pH léků.
rizika léčby
CDI: Toxin produkovaný C difficile, anaerobní, sporulující, gram-pozitivní bakterie, je hlavní příčinou průjmu a kolitidy u hospitalizovaných pacientů, že se zvýšil v incidenci, závažnosti a úmrtnost v posledních letech. V USA se každoročně vyskytuje přibližně 3 miliony případů a náklady na zdravotní péči přesahují 1, 1 miliardy dolarů ročně.14,15 C difficile indukovaná pseudomembranózní kolitida má úmrtnost 6% až 30%.16 CDI se podílí 20% na 30% všech případů antibiotiky spojené průjem, 50% až 75% případů kolitida související s antibiotiky, a více než 90% případů antibiotické spojené pseudomembranózní kolitida u hospitalizovaných pacientů.17
navzdory lepší kontrole předepisování antibiotik a zlepšení hygieny v nemocnici počet případů CDI stále roste.18 k tomu mohla přispět Zlepšená diagnóza, hypervirulentní kmeny a stárnoucí populace, ale tyto faktory plně nevysvětlují rozsah nedávných nárůstů.18 Společné rizikové faktory pro CDI patří věk nad 65 let, současné a opakované hospitalizace, posledních GI operaci, imunosuprese, předchozí CDI, kteří mají bydliště v pečovatelském domě, nebo zařízení dlouhodobé péče, a používání antibiotik. Užívání antibiotik je největším rizikovým faktorem pro vývoj CDI, ale často se mu nelze vyhnout u pacientů s infekcemi. Méně častým, ale modifikovatelnějším rizikovým faktorem je použití ASD u hospitalizovaných pacientů, u kterých tyto léky nejsou indikovány.
žaludeční kyselina je nešpecifický ochranný mechanismus proti požitým patogenům. Žaludek je obvykle bez bakterií, s výjimkou Helicobacter pylori, který je jedinečně vybaven pro řešení žaludeční kyselosti.19 C difficile se přenáší požitím a jeho relativně kyselé stabilní spory dále klíčí v tenkém střevě a tlustém střevě. Vegetativní buňky C difficile, na rozdíl od plísní, jsou obvykle zabity v nízké pH prostředí žaludku; nicméně, bylo zjištěno, zůstávají životaschopné v žaludečního obsahu u pacientů užívajících ASDs. Výzkum na zvířecích modelech ukázal, že spory C difficile se během 1 hodiny po požití transformují na vegetativní buňky. Je pravděpodobné, že k této transformaci může dojít v žaludku, pokud je pH vyšší nebo v případě pomalejších časů průchodu žaludkem.
několik studií zjistilo souvislost mezi použitím PPI nebo H2A a CDI. Nedávná retrospektivní kohortová studie zjistila, že recidivující CDI byl častější u pacientů užívajících Ipp než u neexponované pacientů (25.2% vs. 18,5%) a že PPI použití během CDI léčba byla spojena s 42% zvýšené riziko recidivy.12 exponovaných pacientů ve věku nad 80 let mělo nejvyšší riziko.12 nedávná analýza údajů od pacienta vypouštění z terciární medical center více než 5-leté období bylo zjištěno, že riziko nozokomiální CDI byl pozitivně korelovala s hladinou kyseliny potlačení a byl nejvyšší u pacientů užívajících PPI terapii více než jednou denně, což naznačuje, že dávka-odezva vliv na riziko vzniku nozokomiální CDI.13
pneumonie: Ačkoli výsledky vyšetřování byly nekonzistentní, několik studií zjistilo souvislost mezi použitím ASD a zvýšeným rizikem infekcí dýchacích cest a CAP. Nedávný systematický přehled a meta-analýza naznačuje, že používání Ipp a H2As je spojena s vyšším rizikem obou ČEPICI a HAP, odhad výskyt jednoho případu na zápal plic za každých 200 hospitalizovaných pacientů léčených s ASDs.20 vzhledem k tomu, že 40% až 70% hospitalizovaných pacientů dostává ASD, lze plně ocenit velikost morbidity a mortality HAP. Největší zvýšení rizika pneumonie spojené s PPI bylo pozorováno v prvním týdnu užívání.20
stejně Jako u střevních infekcí, ASDs se, že zvyšují riziko zápalu plic inhibicí sekrece žaludeční kyseliny, což umožňuje bakteriální přerůstání a kolonizace. Bakterie pak mohou být přemístěny do plic aspirací.20 u mechanicky větraných pacientů může orofaryngeální kolonizace gramnegativními organismy vést k kolonizaci žaludku.19 Další teorie spočívá v tom, že adenosintrifosfatáza draselného vodíku je přítomna nejen v parietálních buňkách žaludku, ale také v dýchacím traktu.20 inhibice tohoto enzymu PPI by mohla podpořit růst bakterií v dýchacím traktu, což by vedlo ke zvýšenému riziku pneumonie.20 konečně studie in vitro ukázaly, že ASD mohou narušit funkci neutrofilů a aktivitu přirozených zabijáckých buněk.20
pacienti starší 65 let mají zvýšené riziko pneumonie v důsledku ASD. Nejen, že jsou starší pacienti obecně hypochloric, protože proces stárnutí, ale PPI nebo H2A použití je časté v této skupině; až 5% brát tyto léky pravidelně, a vysoký podíl hospitalizovaných starších pacientů přijímat SUP.21 Navíc, mnoho Ipp a H2As nevyžadují předpis, což má za následek zvýšené a nekontrolované užívání, často na dlouhou dobu bez lékařského dohledu.21
další rizika: kromě CDI byly s ASD spojeny další enterické infekce—zejména z druhů Salmonella a Campylobacter. Jak Campylobacter, tak Salmonella jsou mikroby citlivé na kyselinu. Parazitární infekce byly také spojeny s potlačením kyseliny, zejména giardiasis a strongyloidiasis.22 Jak již bylo zmíněno, žaludeční kyseliny, je důležité v zabíjení požití organismů, ale zvýšené pH v žaludku může mít i jiné negativní účinky na GI hostitele obranu, jako je opožděné vyprazdňování žaludku, zvýšená bakteriální translokace, snížená žaludeční hlenu viskozitu, a změny v normální mikrobiální flóry.23
lékové interakce jsou dalším problémem s potlačením kyseliny. Digoxin, nifedipin, indinavir, midazolam, didanosin, alendronát, metadon, aspirin) mohou být ovlivněny jak PPI, tak H2As, což má za následek zvýšené rychlosti absorpce.9,24 stejně tak několik léků snížilo rychlost absorpce (tj. ketokonazol, cefpodoxim, dipyridamol, atazanavir, itrakonazol).24 existuje mnoho interakcí souvisejících s CYP450 mezi PPI a jinými léky. Potenciální interakce mezi PPI a klopidogrelem přitahovala pozornost kvůli možným závažným nežádoucím účinkům. FDA bezpečnostní upozornění v listopadu 2009 doporučuje vyhnout se užívání omeprazolu a esomeprazolu s klopidogrelem, upozornění, že CYP zprostředkované interakce by mohla snížit účinnost klopidogrelu.22 vzhledem k nedostatečným údajům FDA nevydala žádná konkrétní doporučení týkající se jiných PPI.22
Několik případů pacientů s hypomagnezémií a následné hypokalémie a hypokalcémie, kteří prezentovány s život ohrožující příznaky vyžadující hospitalizaci byly hlášeny. Většina těchto případů byla spojena s dlouhodobým užíváním PPI. Mechanismus tohoto nežádoucího účinku není znám. U pacientů s hypomagnezémií vyvolanou PPI nedošlo k žádné zjevné malabsorpci hořčíku nebo k renálnímu plýtvání hořčíkem.22 ačkoli hypomagnezémie je vzácná, protože je tak život ohrožující poskytovatelé se vyzývají, aby pečlivě sledovali nevysvětlitelnou hypomagnezémii, hypokalémii nebo hypokalcémii u uživatelů PPI.22
použití PPI po dobu 12 měsíců nebo déle bylo spojeno s nedostatkem vitaminu B12, zejména u starších pacientů.9 žaludeční kyselost a pepsin umožňují uvolnění požitého vitaminu B12 z jeho stavu vázaného na bílkoviny; proto může snížení žaludeční kyseliny vést k malabsorpci a nedostatku vitaminu B12.22 výsledky studie byly nekonzistentní a k definování souvislosti mezi užíváním PPI a malabsorpcí vitaminu B12 a následným nedostatkem jsou zapotřebí větší studie. Špatná absorpce železa v potravě byla také spojena s léčbou PPI, ale současná data jsou slabá. Žaludeční kyseliny usnadňuje vstřebávání nonheme železa snížením železitého železa na více rozpustné železnaté formy, a také zvyšuje železo-sůl disociace z požití potravin.22 existuje několik kazuistik, ale v této oblasti nebyly provedeny žádné prospektivní studie.
dlouhodobé užívání PPI bylo spojeno se zvýšeným výskytem zlomenin. Možné mechanismy zahrnují snížení absorpce vápníku ve více alkalické žaludeční prostředí a poškození kostní remodelace způsobená sníženou aktivitu osteoklastů, což vede k inhibována microfracture opravy.22 znovu, studií jsou nekonzistentní, ale stávající důkazy byly dost rychlé FDA revidovat PPI označování v Květnu 2010, aby zahrnovala nové bezpečnostní informace o možné zvýšené riziko zlomenin kyčle, zápěstí a páteře.22 riziko zlomeniny může být klinicky významnější u pacientů s osteoporózou nebo jinými rizikovými faktory zlomeniny, jako je užívání steroidů. Lékařům se doporučuje, aby zvážili rizika a přínosy použití PPI u zranitelných pacientů. Pokud jsou doplňky vápníku předepsány uživatelům PPI, měly by být spíše v rozpustné formě, jako je citrát, než uhličitan.22
vhodné použití
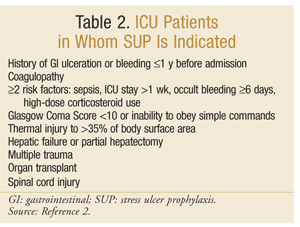
americká společnost lékárníků zdravotnického systému vyvinula jednu z nejkomplexnějších pokynů založených na důkazech pro SUP. Současné terapeutické pokyny byly zveřejněny v roce 1999, přičemž aktualizace probíhá v tomto psaní.25 SUP se nedoporučuje u pacientů bez JIP; profylaxe se doporučuje pouze pro JIP pacientů, kteří vyžadují mechanickou ventilaci delší než 48 hodin, mají historii GI ulcerace nebo krvácení během 1 roku před přijetím, nebo kteří mají koagulopatie. Profylaxe je také doporučuje pro JIP pacientů s alespoň dva z následujících rizikových faktorů: sepse, JIP pobyt delší než 1 týden, okultní krvácení trvající 6 dní a více, a použití vysokých dávek kortikosteroidů (hydrokortizon >250 mg/den nebo ekvivalent). Navíc, SUP se doporučuje pro speciální ICU populace, jako jsou pacienti s Glasgow Coma Score <10 (nebo neschopnost poslouchat jednoduché příkazy), tepelné poranění >35% z plochy povrchu těla, selhání jater nebo částečné hepatektomii, mnohočetné trauma, transplantace, nebo zranění míchy.2 doporučení jsou shrnuta v tabulce 2.
Závěr: Lékárník Roli
Úsilí lékařů omezit používání ASDs v non-ICU pacienti mohou zabránit významným pacienta nemocnost a snížit i náklady nemocnic a náklady na celkový systém zdravotní péče. Je důležité pečlivě zvážit rizika a přínosy ASD před použitím těchto léků v lůžkovém prostředí. Zvláštní pozornost by měla být věnována pacientům, kteří jsou již ohroženi pneumonií, jako jsou starší pacienti, pacienti s chronickým plicním onemocněním a pacienti užívající imunosupresiva. Je třeba vyvinout veškeré úsilí k kritickému posouzení léčby potlačující kyselinu u hospitalizovaných pacientů a k přerušení léčby, kdykoli je to možné. Pokud je indikován SUP, měl by pacient dostat nejnižší možnou dávku.
Lékárníci mohou pomoci kmenových použití ASDs o identifikaci pacientů, kteří jsou nevhodně předepsané léky, a mohou být nápomocna při vzdělávání lékařů, o kterých by pacienti měli dostávat SUP. Lékárníci, kteří se podílejí na zpracování vypouštěcích léků, mohou pomoci zajistit, aby pacienti nebyli posláni domů na terapii potlačující kyselinu bez vhodné indikace. Bohužel opatření přijatá k prevenci stresových vředů u hospitalizovaných pacientů vytvořila nový problém a spoluprací zdravotnického týmu může pomoci zabránit další zbytečné morbiditě prosazováním doporučení pokynů v jejich instituci.
1. Stříkat mj. Stresové slizniční onemocnění: rizikové faktory a profylaktická terapie. Clin There. 2004;26:197-213.
2. ASHP terapeutické pokyny pro profylaxi stresových vředů. Komise ASHP pro terapeutika a schválená představenstvem ASHP dne 14. listopadu 1998. Jsem J Zdraví Syst Pharm. 1999;56:347-379.
3. Cook DJ, Griffith LE, Walter SD, et al. Přičitatelná úmrtnost a délka pobytu na jednotce intenzivní péče u klinicky významného gastrointestinálního krvácení u kriticky nemocných pacientů. Crit Care. 2001;5:368-375.
4. Cook DJ, Fuller HD, Guyatt GH, et al. Rizikové faktory gastrointestinálního krvácení u kriticky nemocných pacientů. Kanadský Critical Care Trials Group. N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. terapeutické cíle a možnosti léčby pro prevenci syndromu stresových vředů. Jsem Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth WE. Gastrointestinální krvácení u pacientů na jednotce intenzivní péče o dýchání. Hruď. 1977;72:301-304.
7. Sesler JM. Slizniční onemocnění související se stresem na jednotce intenzivní péče: aktualizace profylaxe. AACN Adv Crit péče. 2007;18:119-128.
8. Grube RR, Květen DB. Profylaxe stresových vředů u hospitalizovaných pacientů, kteří nejsou na jednotkách intenzivní péče. Jsem J Zdraví Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Nadměrné využití inhibitorů protonové pumpy: přehled nákladové efektivity a rizika v PPI. Jsem J Gastroenterol. 2009; 104 (suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Velikost a ekonomický dopad nevhodného použití profylaxe stresových vředů u pacientů hospitalizovaných na JIP. Jsem J Gastroenterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. proč lékaři předepisují profylaxi stresových vředů pacientům v oblasti všeobecného lékařství? Jižní Med J. 2010; 103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV, et al. Inhibitory protonové pumpy a riziko rekurentní infekce Clostridium difficile. Arch Intern Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Potlačení iatrogenní žaludeční kyseliny a riziko infekce nozokomiální Clostridium difficile. Arch Intern Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Náklady na zdravotní péči a úmrtnost spojená s nozokomiálním průjmem způsobeným Clostridum difficile. Klinická Infekce Dis. 2002;34:346-353.
15. Schroeder MS. Clostridium difficile-spojený průjem. Jsem Fam Lékař. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: nedávné epidemiologické nálezy a pokroky v terapii. Farmakoterapie. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile kolitida. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial s. nadměrné užívání inhibitorů protonové pumpy podporuje současnou epidemii průjmu spojeného s Clostridium difficile? Jaromír Jágr. 2008;70:1-6.
19. Vakil n. inhibice kyseliny a infekce mimo gastrointestinální trakt. Jsem J Gastroenterol. 2009; 104: S17-S20.
20. EOM CS, Jeon CY, Lim JW, et al. Použití léků potlačujících kyselinu a riziko pneumonie: systematický přehled a metaanalýza. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Opakující se komunitní pneumonie u pacientů, kteří zahajují léky potlačující kyselinu. Jsem Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. nežádoucí účinky na dlouhodobou léčbu inhibitory protonové pumpy. Dig Dis Sci. 2011;56:931-950.
23. Dial MS. použití inhibitoru protonové pumpy a enterické infekce. Jsem J Gastroenterol. 2009; 104 (suppl 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. systematický přehled: zhoršená absorpce léčiva související se současným podáváním antisekreční terapie. Aliment Pharmacol Ther. 2009;29:1219-1229.
25. Americká společnost zdravotnického systému lékárníků. Terapeutické guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx, přístup k 19. září 2011.