Profilaxia da úlcera de Stress: as consequências do uso excessivo e do mau uso
us Pharm. 2011;36(10):73-76.
parece que quase todos os doentes admitidos no hospital nos Estados Unidos são prescritos como profilaxia da úlcera de stress (SUP) um inibidor da bomba de protões (PPI) ou um antagonista da histamina-2 (H2A). As úlceras de Stress são erosões da mucosa gástrica que podem desenvolver-se em doentes com doença grave ou lesão grave. Ao contrário das úlceras pépticas, que tendem a desenvolver-se no antro ou duodeno, lesões mucosas relacionadas ao estresse tipicamente ocorrem nas áreas produtoras de ácido do estômago (i.e., corpus e fundus).1 úlceras stressantes, ao contrário das úlceras pépticas, tendem a causar hemorragia gastrointestinal (GI) e não estão associadas a dor abdominal. As alterações das mucosas da lesão da mucosa relacionada com o stress envolvem principalmente pequenas erosões que não levam a hemorragia, mas podem desenvolver-se em úlceras mais profundas, que causam hemorragia.
vários factores contribuem para a formação de úlceras de stress, incluindo a hipersecreção ácida; alteração de mecanismos protectores normais, tais como secreções de muco e bicarbonato; libertação de mediadores, tais como metabolitos do ácido araquidónico, citocinas e radicais livres de oxigénio; e isquemia ao sistema GI.2 Estas erosões podem ocorrer rapidamente (£24 horas de admissão) ou levar mais tempo para se desenvolver (>10-14 dias).2 úlceras de Stress e hemorragias relacionadas causam morbilidade e mortalidade significativas em doentes em estado crítico. Um estudo relatou uma taxa de mortalidade de 46% em doentes em estado crítico com hemorragia gastrointestinal, em comparação com 21% nos doentes sem hemorragia (P <.001).3 outros estudos confirmaram esta elevada taxa de mortalidade.4,5
grandes estudos indicaram que os factores de risco mais fortes para hemorragias GI relacionadas com o stress são ventilação mecânica prolongada e coagulopatia.4 o risco aumenta com o aumento do número de dias de ventilação mecânica e duração da estadia na UCI.Outros factores de risco incluem cirurgia major recente, traumatismo grave, queimaduras graves, traumatismo craniano, doença hepática ou renal aquando da admissão, septicemia e hipotensão.O quadro 1 apresenta uma lista completa dos factores de risco.

terapêutica profiláctica
embora tenha demonstrado ser altamente eficaz na redução do risco de hemorragia mucosa relacionada com o stress e clinicamente importante, a terapêutica profiláctica por si só não diminui a taxa de mortalidade global.7 ainda, a prescrição de PPI ou H2As como SUP é apoiada pela literatura e pelas diretrizes para a população de cuidados críticos. Nos últimos anos, o uso de SUP em doentes não pertencentes à UCI-muitas vezes sem indicação—aumentou. Vários estudos demonstraram o uso excessivo de fármacos anti-ácidos (ASDs); 71% dos pacientes internados são prescritos pela ASDs, com muitos sendo liberados erroneamente com esses agentes.8 muitos pacientes são prescritos inadequadamente ASDs na comunidade, e pouco é feito para interromper estes medicamentos durante a hospitalização. Adicionalmente, os doentes com administração de duas vezes por dia de PPI para o tratamento dos sintomas de refluxo gastroesofágico (DRGE) não são frequentemente rebaixados para uma terapêutica de dose única diária uma vez assintomática.9
a utilização excessiva e a má utilização das DSA podem resultar em danos aos doentes e custos acrescidos para o sistema de cuidados de saúde. O número necessário para tratar (NNT) para prevenir um único episódio de hemorragia gastrointestinal clinicamente significativa na UCI excede 900; o NNT é Desconhecido na configuração não-UCI, mas espera-se que seja muito mais elevado.Em um estudo retrospectivo de coorte em um hospital Acadêmico, os custos hospitalares para SUP no cenário não-UCI foram de US $44.000 por ano e os custos da farmácia em ambulatório foram de quase US $68.000 quando as drogas foram continuadas pós-descarga, para uma despesa anual combinada estimada de quase US $112.000.10 Isso poderia facilmente ter sido evitado.
à luz destas estatísticas, SUP continua a ser superpredado. Em um levantamento transversal baseado na Web avaliando o conhecimento, crenças e comportamento dos médicos em relação à prescrição de SUP em pacientes não-UCI, os medos sobre sangramento de GI e as repercussões legais de não prescrever SUP foram associados a um nível superior de prescrição, enquanto o conhecimento das indicações de SUP e preocupação com os efeitos colaterais foram associados com o comportamento de baixa prescrição.Menos de metade dos médicos conseguiram identificar um único efeito secundário da terapêutica com IPS.Muitos praticantes vêem estas drogas como inofensivas, mas estudos têm sugerido que a terapia PPI e H2A está fortemente associada com uma maior probabilidade de infecção por Clostridium difficile (CDI) e aumento das taxas de recorrência.12,13 outros riscos frequentemente negligenciados associados a esta terapia incluem hipomagnesemia; deficiência de vitamina B12; infecções respiratórias superiores, incluindo pneumonia adquirida pela comunidade (CAP) e pneumonia adquirida pelo hospital (HAP); fraturas da anca, coluna e pulsos; e absorção alterada de medicamentos dependentes do pH.
riscos da terapêutica
CDI: A toxina produzida por C difficile, uma bactéria gram-positiva anaeróbica, formadora de esporos, é uma das principais causas de diarreia e colite em pacientes hospitalizados que tem aumentado em incidência, gravidade e mortalidade nos últimos anos. Aproximadamente 3 milhões de casos ocorrem anualmente nos Estados Unidos, e os custos de saúde excedem US $1,1 bilhão por ano.14,15 c colite pseudomembranosa induzida por difficile tem uma taxa de mortalidade de 6% a 30%.16 CDI tem sido implicada em 20% a 30% de todos os casos de diarreia associada a antibióticos, 50% a 75% dos casos de colite associada a antibióticos, e mais de 90% dos casos de colite pseudomembranosa associada a antibióticos em pacientes hospitalizados.17
apesar de um melhor controlo da prescrição de antibióticos e da melhoria da higiene hospitalar, o número de casos de CDI continua a aumentar.18 melhor diagnóstico, estirpes hipervirulentas, e uma população envelhecida pode ter contribuído para isso, mas estes fatores não explicam completamente a extensão dos aumentos recentes.Os factores de risco comuns para o CDI incluem idade superior a 65 anos, hospitalização actual e recorrente, cirurgia GI recente, imunossupressão, CDI anterior, residente num lar de idosos ou numa instalação de cuidados prolongados, e uso de antibióticos. O uso de antibióticos é o maior fator de risco para o desenvolvimento de CDI, mas muitas vezes não pode ser evitado em pacientes com infecções. Um fator de risco menos comum, mas mais modificável, é o uso de DSA em pacientes hospitalizados nos quais estes medicamentos não estão indicados.O ácido gástrico é um mecanismo de protecção não específico contra os agentes patogénicos ingeridos. O estômago é normalmente livre de bactérias, com exceção de Helicobacter pylori, que é exclusivamente equipado para lidar com a acidez gástrica.19 C difficile é transmitida por ingestão, e seus esporos relativamente estáveis em ácido continuam a germinar no intestino delgado e no cólon. As células vegetativas de C difficile, ao contrário dos esporos, são geralmente mortas no ambiente de baixo pH do estômago; no entanto, eles têm sido encontrados para permanecer viáveis no conteúdo gástrico dos pacientes que tomam ASDs. A pesquisa em modelos animais mostrou que esporos c difficile se transformam em células vegetativas no prazo de 1 hora após a ingestão. É plausível que esta transformação possa ocorrer no estômago se o pH for maior ou no caso de períodos de trânsito gástrico mais lentos.
vários estudos encontraram uma associação entre o uso de PPI ou H2A e CDI. Um estudo retrospectivo recente revelou que o CDI recorrente era mais comum em doentes expostos a PPI do que em doentes não tratados (25, 2% vs. 18, 5%) e que a utilização de PPI durante o tratamento com CDI estava associada a um aumento de 42% do risco de recorrência.12 doentes expostos com mais de 80 anos de idade apresentaram o risco mais elevado.Uma análise recente de dados de descargas de doentes de um centro médico terciário ao longo de um período de 5 anos revelou que o risco de CDI nosocomial estava positivamente correlacionado com o nível de supressão ácida e era mais elevado nos doentes a receber tratamento com PPI mais de uma vez por dia, sugerindo um efeito dose-resposta sobre o risco de CDI nosocomial.13
Pneumonia: Embora os resultados das investigações tenham sido inconsistentes, vários estudos encontraram uma associação entre a utilização de DSA e um risco aumentado de infecções do tracto respiratório e CAP. Uma revisão sistemática recente e meta-análise sugeriram que o uso de PPI e H2As está associado com um maior risco tanto de CAP e HAP, estimando a ocorrência de um caso de pneumonia para cada 200 pacientes tratados com PDS.20 considerando que 40% a 70% dos pacientes internados recebem ASDs, a magnitude da morbilidade e mortalidade do HAP pode ser totalmente apreciada. O maior aumento do risco de pneumonia associado ao PPI foi observado na primeira semana de Utilização.20
tal como acontece com as infecções entéricas, pensa-se que ASDs aumentam o risco de pneumonia inibindo a secreção de ácido gástrico, permitindo assim o crescimento e colonização bacterianas. As bactérias podem então ser translocadas para os pulmões por aspiração.Em doentes mecanicamente ventilados, a colonização orofaríngea com organismos gram-negativos pode levar à colonização gástrica.19 outra teoria é que a adenosina trifosfatase de potássio de hidrogênio está presente não só nas células parietais do estômago, mas também no trato respiratório.A inibição desta enzima por um IPS pode encorajar o crescimento bacteriano no tracto respiratório, levando assim a um risco aumentado de pneumonia.Por último, estudos in vitro demonstraram que as DSA podem afectar a função dos neutrófilos e a actividade das células assassinas naturais.20
os doentes com mais de 65 anos de idade apresentam um risco aumentado de pneumonia devido à síndrome hipereosinofílica avançada / leucemia eosinofílica crónica. Não só os pacientes idosos são geralmente hipocloricos por causa do processo de envelhecimento, mas o uso de PPI ou H2A é comum neste grupo; até 5% tomam estes medicamentos regularmente, e uma alta porcentagem de pacientes idosos hospitalizados recebem SUP.Além disso, muitos PPI e H2As não necessitam de receita médica, resultando em um uso aumentado e não monitorado, muitas vezes por longos períodos de tempo sem supervisão médica.21
outros riscos: para além do CDI, outras infecções entéricas—em particular, das espécies de Salmonella e Campylobacter—foram associadas à ASDs. Tanto a Campylobacter como a Salmonella são micróbios sensíveis ao ácido. As infecções parasitárias também têm sido associadas à supressão ácida, especialmente a giardíase e a estrongiloidíase.Como mencionado anteriormente, o ácido gástrico é importante no abate de organismos ingeridos, mas um pH gástrico elevado pode ter outros efeitos negativos nas defesas do hospedeiro GI, tais como o esvaziamento gástrico atrasado, o aumento da translocação bacteriana, diminuição da viscosidade do muco gástrico e alterações na flora microbiana normal.23
as interacções medicamentosas são outra preocupação com a supressão ácida. Os medicamentos com absorção dependente do pH (isto é, digoxina, nifedipina, indinavir, midazolam, didanosina, alendronato, metadona, aspirina) podem ser afectados tanto pelo PPI como pelo H2As, resultando num aumento das taxas de absorção.Da mesma forma, vários fármacos diminuíram as taxas de absorção (isto é, cetoconazol, cefpodoxima, dipiridamol, atazanavir, itraconazol).Existem muitas interacções relacionadas com o CYP450 entre os IPP e outras drogas. A potencial interacção entre o PPI e o clopidogrel chamou a atenção devido a possíveis efeitos adversos graves. Um alerta de segurança da FDA, em novembro de 2009, recomendou que se evitasse a utilização de omeprazol ou esomeprazol com o clopidogrel, avisando que a interacção mediada pelo CYP pode reduzir a eficácia do clopidogrel.Devido a dados insuficientes, a FDA não fez recomendações específicas relativamente a outros PPI.Foram notificados vários casos de doentes com hipomagnesemia e hipocaliemia e hipocalcemia subsequentes que apresentaram sintomas com risco de vida que requeriam hospitalização. A maioria destes casos foi associada ao uso de PPI a longo prazo. Desconhece-se o mecanismo deste efeito adverso. Em doentes com hipomagnesemia induzida pelo PPI, não ocorreu má absorção aparente de magnésio ou Desperdício renal de magnésio.22 embora a hipomagnesemia seja rara, porque é tão ameaçador para os prestadores de cuidados de saúde são incentivados a observar cuidadosamente para hipomagnesemia inexplicável, hipocaliemia, ou hipocalcemia em Usuários de PPI.22
a utilização de PPI durante 12 meses ou mais tem sido associada a deficiência de vitamina B12, particularmente em doentes idosos.A acidez gástrica e a pepsina permitem a libertação da vitamina B12 ingerida do seu estado ligado às proteínas.; assim, a redução do ácido gástrico pode conduzir a má absorção e a deficiência de vitamina B12.22 os resultados dos estudos têm sido inconsistentes e são necessários estudos de maior envergadura para definir a associação entre a utilização de PPI e a má absorção da vitamina B12 e a deficiência subsequente. A fraca absorção do ferro alimentar também tem sido associada à terapêutica com IPS, mas os dados actuais são fracos. O ácido gástrico facilita a absorção de ferro não-métrico, reduzindo o ferro férrico à forma ferroso mais solúvel, e também aumenta a dissociação ferro-sal de alimentos ingeridos.Existem vários relatórios de casos, mas não foram realizados estudos prospectivos nesta área.A utilização prolongada de PPI tem sido associada a um aumento da incidência de fracturas. Os mecanismos possíveis incluem a diminuição da absorção de cálcio num ambiente gástrico mais alcalino e a diminuição da remodelação óssea devido à diminuição da actividade osteoclastica, conduzindo a uma reparação inibida da microfractura.Mais uma vez, os estudos são inconsistentes, mas a evidência existente foi suficiente para incitar a FDA a rever a rotulagem do PPI em maio de 2010 para incluir novas informações de segurança sobre o possível aumento do risco de fracturas da anca, pulso e coluna vertebral.O risco de fractura pode ser clinicamente mais significativo em doentes com osteoporose ou outros factores de risco de fractura, tais como a utilização de esteróides. Os médicos são incentivados a ponderar os riscos e benefícios do uso do PPI em pacientes vulneráveis. Se os suplementos de cálcio forem prescritos aos utilizadores de IPS, devem ser numa forma solúvel, como o citrato, em vez do carbonato.22
uso apropriado
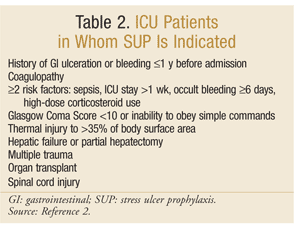
a American Society of Health-System Pharmacists desenvolveu uma das diretrizes mais abrangentes baseadas em evidências para SUP. As atuais diretrizes terapêuticas foram publicadas em 1999, com uma atualização em andamento nesta escrita.O SUP não é recomendado para doentes não pertencentes à UCI.; a profilaxia é recomendada apenas em doentes da UCI que necessitem de ventilação mecânica durante mais de 48 horas, que tenham antecedentes de ulceração GI ou hemorragia no período de 1 ano antes da admissão, ou que tenham coagulopatia. Recomenda-se também profilaxia em doentes da UCI com, pelo menos, dois dos seguintes factores de risco: sépsis, permanência da UCI superior a 1 semana, hemorragia oculta com duração igual ou superior a 6 dias e utilização de doses elevadas de corticosteróides (hidrocortisona >250 mg/dia ou equivalente). Adicionalmente, o SUP é recomendado para populações especiais da UCI, tais como pacientes com uma pontuação de coma de Glasgow <10 (ou incapacidade de obedecer comandos simples), lesão térmica a >35% da área de superfície corporal, insuficiência hepática ou hepatectomia parcial, trauma múltiplo, transplantes ou lesão da medula espinhal.As recomendações estão resumidas no quadro 2.
conclusão: o papel do farmacêutico
os esforços dos médicos para reduzir o uso de DSA em doentes não pertencentes à UCI podem prevenir a morbilidade significativa dos doentes e reduzir tanto os custos hospitalares como os custos para o sistema geral de cuidados de saúde. É importante ponderar cuidadosamente os riscos e benefícios da ASDs antes de utilizar estes medicamentos no ambiente de internamento. Deve ser dada especial atenção aos doentes já em risco de pneumonia, tais como os idosos, os doentes com doença pulmonar crónica e os doentes a tomar imunossupressores. Devem ser envidados todos os esforços para avaliar criticamente a terapêutica anti-ácido em doentes internados e para descontinuar a terapêutica sempre que possível. Quando o SUP estiver indicado, o doente deve receber a dose mais baixa possível.
os farmacêuticos podem ajudar a travar o uso de DSA, identificando os doentes que são inadequadamente prescritos a estes medicamentos, e podem ser fundamentais na educação dos médicos sobre os quais os doentes devem receber SUP. Os farmacêuticos envolvidos no processamento de medicamentos de descarga podem ajudar a garantir que os pacientes não são enviados para casa em terapia anti-ácido sem uma indicação adequada. Infelizmente, as medidas tomadas para prevenir úlceras de stress em pacientes hospitalizados criaram um novo problema, e ao trabalhar em conjunto a equipe de cuidados de saúde pode ajudar a prevenir mais morbilidade desnecessária através da aplicação de recomendações orientadoras em sua instituição.
1. Spirt MJ. Doença da mucosa relacionada com o Stress: factores de risco e terapêutica profiláctica. Clin Ther. 2004;26:197-213.
2. Orientações terapêuticas ASHP para a profilaxia da úlcera de stress. Comissão de terapêutica do ASHP e aprovada pelo Conselho de administração do ASHP em 14 de novembro de 1998. Am J Health Syst Pharm. 1999;56:347-379.
3. Cook DJ, Griffith LE, Walter SD, et al. A mortalidade e a duração atribuíveis da permanência na unidade de cuidados intensivos de hemorragia gastrointestinal clinicamente importante em doentes em estado crítico. Hematócrito. 2001;5:368-375.
4. Cook DJ, Fuller HD, Guyatt GH, et al. Factores de risco para hemorragia gastrointestinal em doentes em estado crítico. Canadian Critical Care Trials Group. N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. objectivos terapêuticos e opções de tratamento para a prevenção da síndrome de úlcera de stress. Am J Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth WE. Hemorragia Gastrointestinal em doentes numa unidade de cuidados intensivos respiratórios. Peito. 1977;72:301-304.
7. Sesler JM. Doença da mucosa relacionada com o Stress na unidade de cuidados intensivos: uma actualização sobre profilaxia. AACN Adv Crit Care. 2007;18:119-128.
8. Grube RR, May DB. Profilaxia da úlcera de Stress em doentes hospitalizados não em unidades de cuidados intensivos. Am J Health Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Overutilization of proton pump inhibitors: a review of cost-effectiveness and risk in PPI. Am J Gastroenterol. 2009; 104(suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Magnitude e impacto económico da utilização inadequada da profilaxia da úlcera de stress em doentes não hospitalizados na UCI. Am J Gastroenterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. porque é que os médicos prescrevem profilaxia de úlceras de stress a doentes de Medicina Geral? South Med J. 2010; 103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV, et al. Inibidores da bomba de protões e risco de infecção recorrente por Clostridium difficile. Medicina Interna Arch. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Supressão do ácido gástrico iatrogénico e risco de infecção nosocomial Clostridium difficile. Medicina Interna Arch. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Custos de cuidados de saúde e mortalidade associados com diarreia nosocomial devido a clostridum difficile. Clin Infect Dis. 2002;34:346-353.
15. Schroeder MS. Clostridium diarreia associada a difficile. Sou Médico Da Família. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: recentes descobertas epidemiológicas e avanços na terapia. Farmacoterapia. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Colite Clostridium difficile. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. é a utilização excessiva de inibidores da bomba de protões a alimentar a actual epidemia de diarreia associada a Clostridium difficile? Infectar J Hosp. 2008;70:1-6.
19. Inibição do ácido Vakil N. e infecções fora do tracto gastrointestinal. Am J Gastroenterol. 2009; 104: S17-S20.
20. Eom CS, Jeon CY, Lim JW, et al. Uso de drogas supressivas ácidas e risco de pneumonia: uma revisão sistemática e meta-análise. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Pneumonia adquirida na comunidade recorrente em pacientes que iniciam drogas de supressão de ácido. Am J Med. 2010;123:47-53.
22. Sheen e, Triadafilopoulos G. efeitos adversos na terapêutica a longo prazo com inibidores da bomba de protões. Dig Dis Sci. 2011;56:931-950.
23. Marque o uso de inibidores da bomba de protões e infecções entéricas. Am J Gastroenterol. 2009; 104 (suppl 2):S10-S16.
24. Lahner e, Annibale B, Della Nave G. Systematic review: impaired drug absorption related to the co-administration of anti-secretory therapy. Farmacol De Pimentão. 2009;29:1219-1229.
25. American Society of Health-System Pharmacists. Terapêutica guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. Accessed September 19, 2011.